��Ŀ����
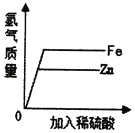
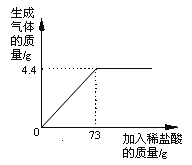
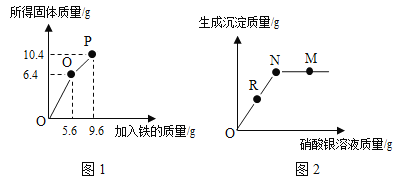
����Ŀ����һ�������Ȼ�ͭ��Һ�м�����������ۣ��������۵����������ù���������ϵ��ͼ1��ʾ������P��ʱ�Ļ�������Һ�в��ϼ�����������Һ���������Һ���������ɳ���������ͼ2��ʾ������˵������ȷ����
A. N��ʱ�����ó�������Ϊ14.35g
B. M��ʱ���ϲ���Һ������������
C. O���P��������Һ������������ͬ
D. R��M������У�������Һ��������������
���𰸡�A
��������
��һ�������Ȼ�ͭ��Һ�м�����������ۣ��������۵����������ù��巢���ķ�Ӧ����ʽ��CuCl2+Fe=Cu+FeCl2������P��ʱ�Ļ�������Һ�в��ϼ�����������Һ��FeCl2+2AgNO3=Fe(NO3)2+2AgCl������ͼ1��֪��O��ʱ��ͭ���ӷ�Ӧ��ȫ�������뷴Ӧ������Ϊ5.6g��
A������Һ�еĺ�FeCl2Ϊx��
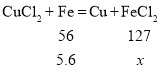 ����
����![]() ���ɵ�x=12.7g��
���ɵ�x=12.7g��
���������Ȼ�������Ϊy��
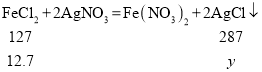 ����
����![]() ���ɵ�y=28.7g��ѡ��A����ȷ��
���ɵ�y=28.7g��ѡ��A����ȷ��
B��M��ʱ�������ӷ�Ӧ��ɣ����ϲ���Һ��ֻ������AgNO3��Fe(NO3)2��ѡ��B��ȷ��
C��O��ʱͭ���ӷ�Ӧ��ɣ���ʱ��Һ������ΪFeCl2��P��ʱ����Һ������ΪFeCl2��ѡ��C��ȷ��
D��R��M������У�������������������ڳ����Ȼ�����������������Һ��������������ѡ��D��ȷ��
��ѡA��

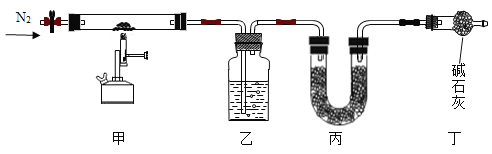
����Ŀ��ij��ѧʵ��С���ͬѧ������ͼ��ʾװ�ý���ʵ��:
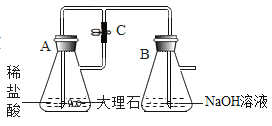
(1)A�з�Ӧ�Ļ�ѧ����ʽΪ_______________
(2)A�з�Ӧ��ʼʱ�����ɼ�C���ڴ�״̬��B �з�Ӧ�Ļ�ѧ����ʽΪ___________________
(3)һ��ʱ���,�ر� C,װ�� A �����ڷ�Ӧ����һ������۲쵽װ�� B�г��ְ�ɫ����,�ó����Ļ�ѧʽΪ________________��
(4)С��ͬѧ̽����Ӧ��װ�� B �е���Һ�����ʳɷ֡�
��������⣩��Ӧ��װ�� B ����Һ�����ʳɷ���ʲô?
����������裩���� 1:NaCl��HCl ���� 2: NaCl��CaCl2
���� 3:NaCl��NaOH ���� 4:NaCl��NaOH��Na2CO3
���������ۣ������ۣ����һ����Ϊ����_______________һ���������������� ______________��
��ʵ��̽��������Ӧ��װ�� B �����û�������ȡ������Һ�ֱ��������ʵ��: ʵ�� 1:����Һ�еμ�̼������Һ���������������_______________����ȷ��
ʵ�� 2:����ݱ���������д��
ʵ���ṩ��ҩƷ��:��̪��Һ��ϡ���ᡢBa��OH)2,��Һ BaC12 ��Һ��
ʵ����� | ������Һ�м������_______________ | ������Һ�еμӷ�̪��Һ |
ʵ������ | _______________ | ______________ |
ʵ����� | ���� 4 ��ȷ | |
����˼���ۣ�ʵ�������ͬѧ�Ǿ������������ۺ���Ϊ:̽����Ӧ��������Һ�����ʳɷ�ʱ,����Ҫ����������,��Ҫ���Ƿ�Ӧ���Ƿ������