��Ŀ����
����Ŀ��ij����С��ͬѧ���֣��ϸ�����ʵ���ù���NaOH��Һ���Ǹ�ƿ�ǡ����ڸ���Һ�Ƿ���ʣ�ͬѧ��������ʦͬ���ʼʵ��̽����
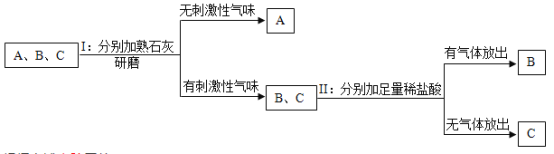
��������裩
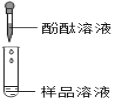
���루1��������Һû�б��ʣ�ΪNaOH��Һ��
���루2��������Һȫ�����ʣ�ΪNa2CO3��Һ��
���루3��������Һ���ֱ��ʣ�ΪNaOH��Na2CO3�Ļ����Һ��
���������ϣ�Na2CO3��Һ�ʼ��ԣ�CaC12��Һ�����ԡ�
����Ʒ��������������±�����ͬѧ̽�ֵ���Ʒ���
ʵ����� | ���ܳ��ֵ���������� | ͬѧ���� | |
��1�� |
| ����Һ��죬����루2�������� | ��2��ͬѧ��Ϊ���˷������۲���ȷ�������ǣ�_____�� |
��2�� |
| ��������ɫ��������Ӧ����ʽΪ��_____������루1���������� | ��3��ͬѧ��Ϊ���˷���������ȷ�����루2�����Dz��루3�������� |
��3�� |
| ����Һ����죬�����_____����������Һ��죬�����_____������ | ��1��ͬѧ��Ϊ���������Ҳ�ܴﵽʵ��Ŀ�ģ����IJ��������ǣ�_____�� |
��̽��ʵ�飩�ۺϸ�С��ķ�������ʵ�顣
�������뷴˼��NaOH��Һ���������CO2��Ӧ�����ʣ�����Ҫ�ܷⱣ�棬������Ӧ�ķ���ʽΪ_____��
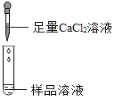
����չ���죩��1����2�����õ�CaC12��Һ������_____��Һ���棬ʵ������һ�¡�
��2�������ʱ�䱩¶�ڿ�����NaOH��Һ���㻹��ʲô���Ļ�ѧ������������ʣ�����Ƶ�ʵ�鲽��������ǣ�_____��
���𰸡�̼������Һ�ʼ��� Na2CO3+CaCl2��CaCO3��+2NaCl ��2�� ��3�� ��2��ʵ����������Թܾ���һ��ʱ�䣬ȡ�ϲ���Һ�μӷ�̪��Һ CO2+2NaOH�TNa2CO3+H2O BaC12 ��¶�ڿ�����NaOH��Һ�еμ�ϡ���ᣬ�������ݲ�����֤����������δ���ʣ���һ��ʱ��������ݲ�����֤���������Ʋ��ֱ��ʣ������������ݲ�����֤����������ȫ������
��������
��Ʒ�����
��1�飺̼������Һ�ʼ��ԣ�Ҳ��ʹ��̪��Һ��죻
��2�飺̼���������Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ���Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+CaCl2��CaCO3��+2NaCl�������Ȼ�����Һ����������˵������̼���ƣ�
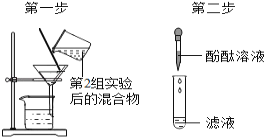
��3�飺����Һ����죬����Һ�в����������ƣ�����루2������������Һ��죬����Һ�к��������ƣ�����루3���������������Ҳ�ܴﵽʵ��Ŀ�ģ����IJ��������ǵ�2��ʵ����������Թܾ���һ��ʱ�䣬ȡ�ϲ���Һ�μӷ�̪��Һ���ɣ�
�����뷴˼��
������̼���������Ʒ�Ӧ����̼���ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��CO2+2NaOH�TNa2CO3+H2O��
��չ���죺
��1��BaC12�����ԣ���̼�����а�ɫ���������������CaC12��Һ���̼���ƣ�
��2��̼���������ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼���������������ᷴӦ�����Ȼ��ƺ�ˮ��̼�������������ƵĻ����Һ�м�������ʱ�����������������Ʒ�Ӧ������������ȫ��Ӧ���������̼���Ʒ�Ӧ�ų����ݡ�����ϡ�������̼�����Ƿ���ʣ���Ƶ�ʵ�鲽��������ǣ���¶�ڿ�����NaOH��Һ�еμ�ϡ���ᣬ�������ݲ�����֤����������δ���ʣ���һ��ʱ��������ݲ�����֤���������Ʋ��ֱ��ʣ������������ݲ�����֤����������ȫ�����ʡ�