题目内容
【题目】某课外活动小组对失去标签的稀硫酸浓度进行测定:取稀硫酸50g于烧杯中,逐滴滴加3.42%的氢氧化钡溶液,烧杯内溶质质量与滴加氢氧化钡溶液质量关系如下图所示。(结果保留两位小数)
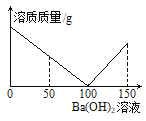
(1)参加反应的Ba(OH)2质量共有 g。当滴加Ba(OH)2溶液50g时,烧杯内溶液的pH 7(填“>”“<”或“=”)。
(2)求该硫酸溶液的溶质质量分数(写出答题过程,结果保留0.01%)。
(3)在下图中画出产生沉淀质量与滴加Ba(OH)2溶液的质量关系。

(4)滴加Ba(OH)2溶液至150g时,所得溶液的溶质质量分数为 (结果保留0.01%)。
【答案】(1)3.42;<;(2)3.92%;(3)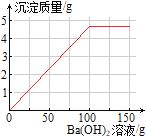 ;(4)0.87%
;(4)0.87%
【解析】对失去标签的稀硫酸浓度进行测定。根据所学知识和题中信息知,(1)参加反应的Ba(OH)2质量共有3.42%×100g=3.42 g。当滴加Ba(OH)2溶液50g时,此时硫酸过量,溶液呈酸性,烧杯内溶液的pH<7。
(2)解∶设该硫酸溶液的溶质质量分数为x
H2SO4+Ba(OH)2=BaSO4↓+2H2O
98 171
50g×x 3.42g
![]() =
=![]() ,x=3.92%。
,x=3.92%。
(3)产生沉淀质量与滴加Ba(OH)2溶液的质量关系图∶
(4)解∶设生成硫酸钡质量为x
H2SO4+Ba(OH)2=BaSO4↓+2H2O
171 233
3.42g x
![]() =
=![]() ,x=4.66g。
,x=4.66g。
滴加Ba(OH)2溶液至150g时,所得溶液的溶质质量分数为∶
![]() ×100%=0.87%。
×100%=0.87%。
点睛∶灵活应用质量守恒定律和正确书写化学方程式是顺利完成本题的重要保证。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目