题目内容
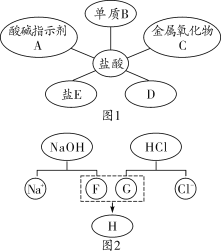
【题目】下列实验设计能达到实验目的的是( )
选项 | 实验目的 | 实验设计 |
A | 除去铁制品表面的铁锈 | 将铁制品长时间浸泡在稀盐酸中 |
B | 检验某溶液中是否含有 | 滴加氯化钡溶液 |
C | 区分盐酸、氯化钾、氯化钙三种溶液 | 滴加碳酸钠溶液 |
D | 分离氯化钠和氯化镁晶体 | 溶解,加入适量氢氧化钠溶液,过滤,蒸发结晶 |
A.AB.BC.CD.D
【答案】C
【解析】
除去铁制品表面的铁锈,长时间浸泡在稀盐酸中,当铁锈与稀盐酸反应完后,铁会与稀盐酸反应,不符合除杂原则,A不能达到实验目的;检验某溶液中是否含有SO![]() ,滴加氯化钡溶液,若有白色沉淀生成,并不能说明一定含有硫酸根,如溶液中含有碳酸根或银离子也会生成白色沉淀,B不能达到实验目的;区分盐酸、氯化钾、氯化钙三种溶液,滴入碳酸钠溶液后,有气泡产生的是盐酸,有沉淀产生的是氯化钙溶液,无明显现象的是氯化钾溶液,C能达到实验目的;分离氯化钠和氯化镁晶体,溶解,加入适量氢氧化钠溶液,氯化镁与氢氧化钠溶液反应生成氢氧化镁沉淀,过滤,蒸发结晶得到氯化钠晶体,但氢氧化镁没有复原为氯化镁,应该向沉淀中加入足量的稀盐酸,蒸发结晶,D不能达到实验目的。
,滴加氯化钡溶液,若有白色沉淀生成,并不能说明一定含有硫酸根,如溶液中含有碳酸根或银离子也会生成白色沉淀,B不能达到实验目的;区分盐酸、氯化钾、氯化钙三种溶液,滴入碳酸钠溶液后,有气泡产生的是盐酸,有沉淀产生的是氯化钙溶液,无明显现象的是氯化钾溶液,C能达到实验目的;分离氯化钠和氯化镁晶体,溶解,加入适量氢氧化钠溶液,氯化镁与氢氧化钠溶液反应生成氢氧化镁沉淀,过滤,蒸发结晶得到氯化钠晶体,但氢氧化镁没有复原为氯化镁,应该向沉淀中加入足量的稀盐酸,蒸发结晶,D不能达到实验目的。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
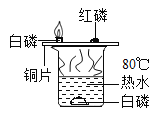
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】(7分)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
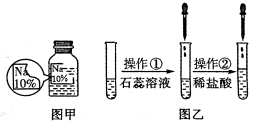
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
【探究过程】
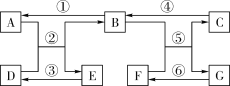
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由: 。
【题目】“舌尖上的中国”在央视上的热播让厨房再次成为人们施展厨艺的舞台。大多数厨师有个工作经验:炒菜时,又加料酒又加醋,可使菜变得香美可口,原因是醋中的乙酸与料酒中的乙醇生成乙酸乙酯。下表中是几种常见的酯,请完成下列问题:
酯的名称 | 甲酸甲酯 | 甲酸乙酯 | 乙酸甲酯 | 乙酸乙酯 |
化学式 | C2H4O2 | C3H6O2 | C3H6O2 | X |
(1)甲酸甲酯(C2H4O2)中碳元素、氢元素、氧元素的质量比为 _______;
(2)甲酸乙酯(C3H6O2)中碳元素的质量分数为_______(计算结果精确到0.1%);
(3)比较归纳是学习化学的重要方法,据表推测X的化学式为________。
【题目】下列应用的叙述、对应的化学方程式及基本反应类型均正确的是( )
选项 | 用途 | 化学原理(用化学方程式表示) | 基本反应类型 |
A | 高炉炼铁 | 3CO+2Fe2O3═2Fe+3CO2 | 置换反应 |
B | 稀盐酸用于除铁锈 | Fe2O3+2HCl═FeCl2+2H2O | 化合反应 |
C | 用熟石灰处理硫酸厂废液 | Ca(OH)2+H2SO4═CaSO4+2H2O | 复分解反应 |
D | 电解水制氢气 | 2H2O═2H2+O2 | 分解反应 |
A. A B. B C. C D. D
【题目】硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示(不考虑气体在水中的溶解).请计算:
反应前 | 反应后 | ||
实验数据 | 烧杯和过氧化氢溶液的质量/g | 硫酸铜溶液的质量/g | 烧杯和烧杯中溶液的质量/g |
60 | 3.3 | 62.5 | |
(1)生成氧气的质量为________.
(2)反应后烧杯中溶液溶质的质量分数.(写出计算过程,结果精确到0.1%).