题目内容
【题目】用镁和硫酸镁固体混合物测定稀硫酸溶质质量分数,先称取10g固体混合物,放入一干净的烧杯中,然后取100g某溶质质量分数的稀硫酸,平均分五次加入其中,充分反应,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 0.12 | m | 0.36 | 0.4 | n |
(1)上表中m=__________、n=___________
(2)请计算所用稀硫酸的溶质质量分数(结果保留一位小数)__________。
【答案】m=0.24 n=0.4 29.4%
【解析】
(1)根据表中数据分析可知m值为0.24g,n=0.4g;
(2)根据表中的数据可知,第一次硫酸完全反应,依据生成的氢气质量进行计算。
(1)第1次和第3次反应生成的氢气质量相等,都是0.12g,所以第2次加入稀硫酸完全反应后,一共产生0.24g氢气,m的数值为0.24g.而第四次只有0.4g,已经完全反应,所以n=0.4g;
(2)根据表中的数据可知,第一次硫酸完全反应,依据生成的氢气质量进行计算;
设参加反应的硫酸的质量分数为x,
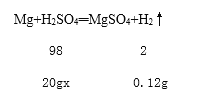
![]()
x=29.4%。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目