��Ŀ����
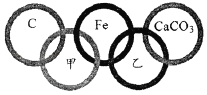
����Ŀ��2022���24�춬�����˻Ὣ�ڱ����к��żҿ������Ͼ��С���ͼ��ʾ�����廷���мס��ҷֱ���O2��Fe2O3ϡ����Ca��OH��2���������е�һ�֡�
��1�������廷�����ཻ�����е����ʼ��ܹ�������ѧ��Ӧ����ش��������⣺
�١��廷�������е�3�������У����ڻ��������_____��
��C���Ӧ������Ϊ_____����������Fe��Ӧ�Ļ�ѧ����ʽΪ_____��
�ۡ��廷���е�����Fe�����滻��_____����һ�ּ��ɣ���
��2�����ײ�����Fe��Ӧ���ܹ��ת�������ɼ�����Fe�ķ�Ӧ����ʽΪ_____��
���𰸡�CaCO3 �����⡢�ų������� Fe+2HCl=FeCl2+H2�� Mg����Al Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
��������
��1�������廷�������е�3�������У�̼������ڻ��������̼�����ڵ��ʣ��������ڻ�������� CaCO3��
�ڼס��ҷֱ���O2��Fe2O3��ϡ���ᡢCa��OH��2���������е�һ�֣������Ҿ��ܺ�����Ӧ�������ܺ�̼��Ʒ�Ӧ��������Ϊϡ���ᣬ��Ϊ����������C���Ӧ��̼��������ȼ�յ�����Ϊ �����⡢�ų������ȣ�������Ϊ ϡ����÷�Ӧ�ķ���ʽΪ��Fe+2HCl��FeCl2+H2����
�����廷���е�����Fe�ȿ���������ȼ��Ҳ���Ժ�ϡ���ᷴӦ������Ϊ Mg����Al�������������𰸣���
��2�����ײ�����Fe��Ӧ���ܹ��ת�������֪��Fe2O3�����ɼ�����Fe�ķ�Ӧ����ʽΪ��Fe2O3+3CO![]() 2Fe+3CO2��
2Fe+3CO2��

����Ŀ������ʯ��ʯ����Ҫ�ɷ� CaCO3��������ʯ�ң�CaO���Ͷ�����̼��Ϊ�˲ⶨijʯ��ʯ��̼��ƣ�CaCO3���ĺ������ֳ�ȡ 24.0g ʯ��ʯ��Ʒ�������Ĵθ������ա���ȴ������ʣ���������� �����ʲ��μӷ�Ӧ������¼ʵ���������£�
���� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
ʣ��������� | 21.6g | 19.2g | 15.2g | 15.2g |
�Լ��㣺
��1����ȫ��Ӧ�����ɶ�����̼������Ϊ_____��
��2�����ʯ��ʯ��Ʒ��̼��Ƶ�����_____��
����Ŀ��ʯ��ʯ�����Ŀ��֮һ��ѧУ�о���ѧϰС��Ϊ�˲ⶨ���ؿ�ɽʯ��ʯ��̼��Ƶ�����������ʯ��ʯ�����������ʼȲ�����ˮҲ����ϡ���ᷴӦ����ȡ����10�˵Ŀ�ʯ��Ʒ����ȡϡ����80 g��ƽ���ֳ�4�ݣ����μ������4��ʵ�飬������£�
ʵ�� | 1 | 2 | 3 | 4 |
��ʯ��Ʒ����/g | 10 | 10 | 10 | 10 |
ϡ��������/g | 20 | 40 | 60 | 80 |
����CO2������/g | 0.88 | 1.76 | 2.2 | m |
��1���ϱ���m����ֵ��_________��
��2���Լ�������ʯ��ʯ����̼��Ƶ���������______����д��������̣�