题目内容
【题目】如图实验,将针筒内温度相同的全部液体迅速注入容器中,实验内容如表所示.
实验编号 | 容器Ⅰ | 针筒Ⅰ | 容器Ⅱ | 针筒Ⅱ | 红墨水液面位置 |
a | 二氧化碳(充满且足量) | 5mL饱和澄清石灰水 | 二氧化碳(充满且足量) | 5mL较浓的氢氧化钠溶液 | 保持左低右高 |
b | 0.65g锌 | 15mL盐酸 | 0.24g镁 | 15mL盐酸 | 最终左右相平 |
(注:实验开始前红墨水左右两端液面保持相平,容器Ⅰ、Ⅱ体积相同,装置气密性良好)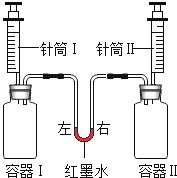
(1)实验a中,容器Ⅰ内开始时产生的现象是 , 红墨水液面位置变化的原因是 .
(2)实验b中,针筒内盐酸足量且溶质质量分数相同,开始时红墨水的位置变化是 , 其原因是 , 最后左右相平说明 , 请写出容器Ⅱ中反应的化学方程式 .
【答案】
(1)石灰水变浑浊;氢氧化钠溶液比氢氧化钙溶液更易吸收二氧化碳
(2)左高右低;镁条更活泼,反应速率更快;生成的氢气质量相等;Mg+2HCl═MgCl2+H2↑
【解析】解:(1)实验a中,氢氧化钠溶液吸收二氧化碳比较彻底,而氢氧化钙吸收二氧化碳的能力较差,因此红墨水液面位置保持左高右低;是因为二氧化碳和石灰水中的氢氧化钙反应生成了碳酸钙沉淀和水,二氧化碳能使澄清石灰水变浑浊;故填:石灰水变浑浊,氢氧化钠溶液比氢氧化钙溶液更易吸收二氧化碳;(2)实验b中,0.65g锌和足量的稀盐酸反应生成的氢气质量等于0.24g镁和足量的稀盐酸反应生成的氢气质量,因此最终红墨水左右两端液面保持相平;因为镁和稀盐酸反应比锌和稀盐酸反应剧烈,所以红墨水的位置先是左高右低.故填:左高右低; 镁条更活泼,反应速率更快; 生成的氢气质量相等; Mg+2HCl═MgCl2+H2↑.
【考点精析】解答此题的关键在于理解金属材料的选择依据的相关知识,掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属,以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】除去下列各物质中的少量杂质,所用方法不可行的是( )
选项 | 物质 | 杂质 | 除去杂质的方法 |
A | Cu粉 | Fe粉 | 用磁铁吸出 |
B | NaCl | 泥沙 | 加水溶解、过滤、蒸发 |
C | NaOH | Na2CO3 | 滴入足量稀盐酸至不再产生气泡 |
D | O2 | 水蒸气 | 通过盛有浓硫酸的洗气瓶 |
A.A
B.B
C.C
D.D