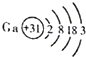题目内容
【题目】碱式碳酸铜又称铜绿,化学式为[Cu2(OH)2CO3],某化学兴趣小组同学发现铜绿受热分解后除生成CO2和H2O外,试管中还有一些黑色粉末状固体.请结合所学知识,回答下列问题:(小资料:无水硫酸铜为白色粉末,与水变蓝色) 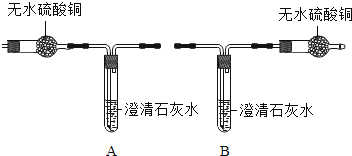
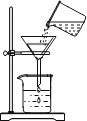
(1)若要证明有CO2和 H2O生成,应选择图示装置是(填字母序号);理由是 .
(2)探究黑色粉末的成分.
【猜想与假设】该黑色粉末可能是①只有碳粉,②只有氧化铜,③;
李明同学经过认真分析,认为上述猜想一定不正确(填序号);其理由是;
【查阅资料】a.碳粉与氧化铜均为不溶于水的黑色粉末;b.氧化铜能与稀盐酸反应形成蓝色溶液;c.碳粉既不与稀盐酸反应也不溶解在稀盐酸中.
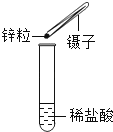
(3)【实验验证】请你帮小组同学完成下述实验报告.
实验步骤 | 实验现象 | 实验结论 |
猜想②正确 |
铜绿受热分解的化学反应方程式: .
【答案】
(1)A;若选B,则气体经过石灰水后会带出一部分水蒸气,干扰原水蒸气的检验
(2)碳粉和氧化铜的混合物;①;铜绿[Cu2(OH)2CO3]受热分解后生成的CO2和H2O中,含有碳元素、氢元素和氧元素,依据化学反应前后元素的种类不变,可知所得黑色粉末中一定含有铜元素
(3)向黑色粉末中加入足量的稀盐酸;黑色粉末全部溶解,溶液呈蓝色;Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
【解析】解:(1)若要证明有CO2和H2O生成应该先验证水再验证二氧化碳,所以应选择的装置是A;理由是若选B,则气体经过石灰水后会带出一部分水蒸气,干扰原水蒸气的检验;(2)【猜想与假设】黑色粉末可能是碳粉和氧化铜的混合物;铜绿[Cu2(OH)2CO3]受热分解后生成的CO2和 H2O中,含有碳元素、氢元素和氧元素,依据化学反应前后元素的种类不变,可知所得黑色粉末中一定含有铜元素,所以猜想①一定不正确; 【实验验证】氧化铜能与稀硫酸反应形成蓝色溶液,碳粉既不与稀硫酸反应也不溶解在稀硫酸中,所以取少量黑色粉末于试管中,加入足量的稀硫酸,加热,观察到黑色粉末全部溶解,溶液变为蓝色,则猜想②正确;铜绿[Cu2(OH)2CO3]受热分解生成氧化铜、水和二氧化碳,化学反应方程式:Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑;
2CuO+H2O+CO2↑;
所以答案是:(1)A;若选B,则气体经过石灰水后会带出一部分水蒸气,干扰原水蒸气的检验;(2)碳粉和氧化铜的混合物;猜想①;铜绿[Cu2(OH)2CO3]受热分解后生成的CO2和H2O中,含有碳元素、氢元素和氧元素,依据化学反应前后元素的种类不变,可知所得黑色粉末中一定含有铜元素;
实验步骤 | 实验现象 | 实验结论 |
向黑色粉末中加入足量的稀盐酸 | 黑色粉末全部溶解,溶液呈蓝色. | 猜想②正确 |
Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑.
2CuO+H2O+CO2↑.
【考点精析】根据题目的已知条件,利用书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握注意:a、配平 b、条件 c、箭号.

【题目】如图实验,将针筒内温度相同的全部液体迅速注入容器中,实验内容如表所示.
实验编号 | 容器Ⅰ | 针筒Ⅰ | 容器Ⅱ | 针筒Ⅱ | 红墨水液面位置 |
a | 二氧化碳(充满且足量) | 5mL饱和澄清石灰水 | 二氧化碳(充满且足量) | 5mL较浓的氢氧化钠溶液 | 保持左低右高 |
b | 0.65g锌 | 15mL盐酸 | 0.24g镁 | 15mL盐酸 | 最终左右相平 |
(注:实验开始前红墨水左右两端液面保持相平,容器Ⅰ、Ⅱ体积相同,装置气密性良好)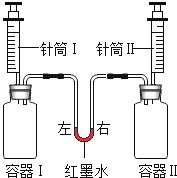
(1)实验a中,容器Ⅰ内开始时产生的现象是 , 红墨水液面位置变化的原因是 .
(2)实验b中,针筒内盐酸足量且溶质质量分数相同,开始时红墨水的位置变化是 , 其原因是 , 最后左右相平说明 , 请写出容器Ⅱ中反应的化学方程式 .
【题目】根据表中相关信息,回答下列问题:
(1)
主族 | ⅠA(第一主族) | ⅡA(第二主族) | ⅢA(第三主族) |
第2周期 |
|
|
|
第3周期 |
|
| X |
第4周期 | Y |
|
|
①X处对应原子的最外层电子数为 ,Y处对应原子的核外电子层数为 ;
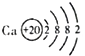
②镓原子(Ca)的核外电子数为 ,其在化学反应中易 (填“得”或“失”)电子形成镓离子,该离子符号为 .
(2)物质甲和乙完全反应生成物质丙和丁,各物质的微观示意图如表2所示,下列说法正确的有
物质 | 甲 | 乙 | 丙 | 丁 |
分子示意图 |
|
|
|
|
a.甲物质属于有机物
b.该反应属于置换反应
c.反应前后元素的种类增加
d.该反应的化学方程式为:C2H2+3O2═2CO2+2H2O.