题目内容
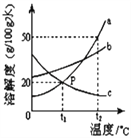
【题目】实验小组用传感器探究稀氢氧化钠溶液与稀盐酸反应过程中温度和pH的变化,测定结果如图所示。下列说法正确的是

A. 实验中溶液的温度一直升高、pH一直增大 B. 氢氧化钠与盐酸的中和反应先放热后吸热
C. 40s时溶液中的溶质为氢氧化钠和氯化钠 D. 该实验是将稀氢氧化钠溶液滴入稀盐酸中
【答案】D
【解析】A、由稀NaOH溶液与稀盐酸反应过程中温度的变化图可知,实验中溶液的温度升高后又降低,pH一直增大但不会超过14,故选项说法错误;B、由稀NaOH溶液与稀盐酸反应过程中温度的变化图可知,反应过程中有热量放出,故选项说法错误;C、40s时,溶液的pH小于7,溶液显酸性,溶液中溶质为HCl和NaCl,故选项说法错误;D、图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸中,故选项说法错误。故选D。

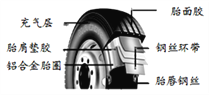
【题目】金属的性质
金属材料是现代生活和工农业生产中应用极为普遍的一类重要物质。请回答下列问题:
(1)请阅读以下信息,并将文中错误的描述标出:_______________ (填写序号)。
①金属都具有银白色金属光泽,②有良好的导电性和导热性。③汞是熔点最高的金属。④合金是由金属与其他金属或非金属熔合而成的,⑤合金是具有金属特性的纯净物,⑥合金一般比组成它的金属硬度大。
(2)大多数金属化学性质活泼,但活泼性有差异。例如,锌、铁、铝这三种金属与氧气或酸液等物质的反应的剧烈程度各有差异。请根据这三种金属的性质完成下面的表格。
反应现象描述 | 对应的金属 (化学式) | 构成该金属的粒子 (粒子符号) | 反应的化学方程式 | 基本反应类型 |
纯氧炉中火星四射 | _____ | _____ | _____ | _____ |
常温即形成致密氧化膜 | _____ | _____ | _____ | _____ |
与稀硫酸反应剧烈程度居中 | _____ | _____ | _____ | _____ |
(3)大多数金属暴露在空气中都易被腐蚀,请举两条防止金属锈蚀的措施:①____________;②____________。
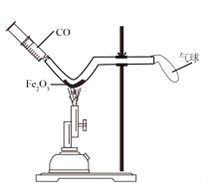
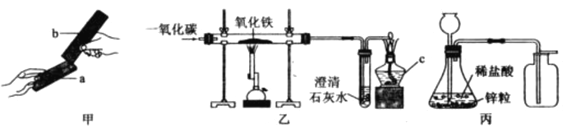
回收重新冶炼是保护金属资源的一条有效途径。请写出用一氧化碳在高温条件下还原锈蚀钢铁(主要成分是Fe2O3)的化学方程式:__________________。
但有时我们也会利用锈蚀为生活服务,请写出下列金属的应用原理:
① 食品袋中的铁粉 ②
食品袋中的铁粉 ② 暖贴中的铁粉 ③
暖贴中的铁粉 ③ 暖气片上涂的铝粉
暖气片上涂的铝粉
①___________________ ;②________ ;③________________ 。
(4)从金属的原子结构看,金属易与其它物质发生反应的根本原因是________________。