题目内容
【题目】鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3,里面覆盖一层蛋壳膜。我校兴趣小组的同学为此开展了以下探究活动:
【提出问题1】
(1)鸡蛋白中含有的营养成分是_________________。
【查阅资料】
a.蛋壳是经过自然形成。科学手段检测蛋壳中含CaCO3约82%—85%,蛋白质15%—17%,并含多种微量元素;
b.蛋壳膜中蛋白质约占90%—93%。
【提出问题2】
蛋壳中的CaCO3含量是多少呢?小华拟将该蛋壳放在空气中充分灼烧完成测定;小明拟通过蛋壳与稀盐酸反应完成测定。请你参与他们的探究。
【设计方案】他们分别称取12.0 g蛋壳设计了以下不同的实验方案:
(2)小华的方案:
称取12.0 g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g。则:产生的CO2质量__________g,蛋壳中的CaCO3的质量分数为________%(结果保留到小数点后一位)。
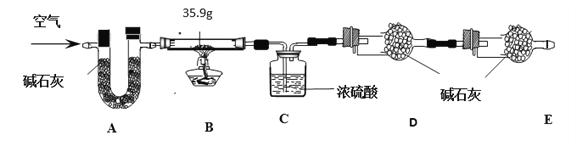
(3)小明的方案:小明设计了如下图所示的实验装置。(已知其他成分均不与稀盐酸反应,装置内试剂均足量)
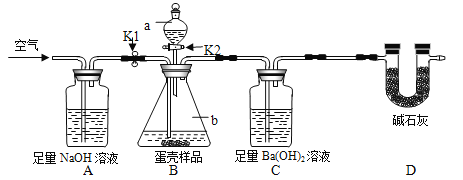
【实验步骤】
① 出编号仪器的名称:a___________,b__________;
② 按上图连接好装置后,并________________;
③ 向B装置中加入蛋壳样品后,先通入空气一会儿;
④ __________K1,_________K2(填“打开”或“关闭”),向蛋壳样品中滴入10%的盐酸,直到B中___________________为止(填实验现象);
⑤ 再通入一会儿空气,目的是___________________;
⑥ 将装置C中的固液混合物过滤、洗涤、干燥后称量其质量;
⑦ 重复上述实验。
【实验数据】重复实验,3次数据记录如下:
实验次数 | 实验1 | 实验2 | 实验3 |
装置C中沉淀质量(g) | 19.68 | 19.75 | 19.67 |
【实验分析及数据处理】
① 上述数据能否用托盘天平称量_______________。(填“能”或“不能”)
② 若无A装置,直接通入空气,则测定结果将___________。(填“偏大”、“偏小”或“不变”)
③ 实验重复3次的目的是____________________。
④ 请利用3次实验数据的平均值,计算该蛋壳中的CaCO3含量____________(已知:BaCO3相对分子量为197,结果保留到小数点后一位)。(请写出具体的计算过程,该空2分)
【实验反思】
(1)下列各项措施中,能提高小明测定准确度的是____________________(填字母序号)。
A.在装置A、B之间增加盛有浓硫酸的洗气瓶
B.缓缓滴加稀盐酸
C.在装置B、C之间增加盛有饱和NaHCO3的洗气瓶
(2)大家讨论后,一致认为小明的方案更合理,你认为小华方案存在较大误差的原因主要是______________。
【答案】 蛋白质 4.84 91.7% a:分液漏斗 b:锥形瓶 检查气密性 关闭 打开 不再产生气泡 将生成的二氧化碳全排入到C中 不能 偏大 减小实验误差 83.3% B 蛋壳中蛋白质灼烧也会产生气体
【解析】(1).鸡蛋白中含有的营养物质是 蛋白质 (2). 据质量守恒定律可知,反应前后物质的总质量不变,所以生成二氧化碳的质量为12.0 g-7.16g=4.84g, (3)设样品中碳酸钙的质量为x
CaCO3高温CaO+CO2↑
100 44
X 4.48g
100/x=44/4.84g x=11g 蛋壳中的CaCO3的质量分数为 11g÷12g×100%≈91.7%
. 91.7% (4). a:分液漏斗 (5). b:锥形瓶 (6). 组装好仪器后,要先检查气密性 ,然后再加入药品。 (7). 关闭K1 停止通入空气 (8). 打开 K2使产生的二氧化碳及时导出,被氢氧化钡溶液吸收 (9). 向蛋壳样品中滴入10%的盐酸,直到B中不再产生气泡,说明蛋壳中碳酸钙被完全反应, (10). 反应后装置内残留的气体为生成的二氧化碳,再通入一会儿空气,目的是将生成的二氧化碳全排入到C中 ,被充分吸收,否则易导致测定结果偏小; (11). 托盘天平称量固体物质的质量时可精确到一位小数,而实验中称量数据精确到两位小数,所以不能用托盘天平称量; (12). 若无A装置,直接通入空气,则氢氧化钡吸收的是生成的二氧化碳和空气中二氧化碳的总量,则测定结果将偏大 (13). 多次称量可避免偶然误差,使测定结果更准确 (14). 三次称量所得碳酸钡的平均质量为19.7g,设蛋壳中碳酸钙的质量为y,则 CaCO3~ CO2~ BaCO3
100 197
y 19.7g
100/y=197/19.7g y=10g 该蛋壳中的CaCO3含量为:10g÷12g×100%≈ 83.3% (15).氢氧化钡不吸水,没必要添加盛浓硫酸的干燥装置,通过缓缓滴加稀盐酸能使盐酸中的氯化氢和蛋壳中的碳酸钙被充分反应,防止了氯化氢挥发,也能使防止因气体流速太快,不能充分吸收,使测定结果更准确; (16). 蛋壳中蛋白质灼烧也会产生气体。使固体减少的质量比实际生成二氧化碳的量多,所以测定结果偏大。

 名校课堂系列答案
名校课堂系列答案【题目】(5分)粗盐中含泥沙、氯化钙、氯化镁等杂质,某同学自制的简易净水器(如图1)中放置物质的顺序错误,使净水效果不理想。

(1)请按由上到下的顺序重新排列 (填字母).调整后净化的盐水仍含可溶性杂质,他设计了下面的除杂流程:
(2)如图2中步骤①②都需要进行 操作,步骤④需要进行 操作;
(3)已知试剂X是碱溶液,则沉淀Ⅰ为 (写化学式),下列碱溶液不符合要求的是_________(填序号)。
A.氢氧化钠溶液 | B.氢氧化钡溶液 | C.氢氧化钾溶液 | D.氢氧化钙溶液 |
(4)步骤②除去氯化钙的反应方程式是 ;步骤③中发生中和反应的化学方程式是 。
【题目】实验员小周在学期末整理实验仪器时发现有一瓶标签模糊的溶液,如下图。

请你和小周一起探究该溶液的成分,并测定其质量分数。
第一步:猜想并验证该溶液的溶质是什么。
猜想:根据标签可知,这瓶溶液可能是HCl、KCl、NaCl等含有氯离子的酸或盐。
验证:
步骤 | 现象 | 结论 |
取样,滴加紫色石蕊 | 溶液变成_______色 | 这瓶溶液是盐酸 |
第二步:测定该溶液的溶质质量分数
实验原理:⑴用已知浓度的氢氧化钠溶液和盐酸反应,反应的化学方程式为:______________
⑵当盐酸和氢氧化钠恰好完全反应时,再增加一滴氢氧化钠溶液,溶液就呈碱性(可以使无色酚酞变成红色),而一滴氢氧化钠溶液的体积约为0.05ml,对测定结果的影响很小可忽略不计。
实验步骤:⑴取未知浓度的盐酸20g倒入烧杯中,向其中滴加2滴无色酚酞溶液。此时溶液呈_____色。
(2)量取质量分数1%的氢氧化钠溶液50ml(密度近似为1.0g/ml),用胶头滴管逐滴滴加该氢氧化钠溶液到盐酸中,观察到_______________,停止滴加,剩余氢氧化钠溶液的10ml。
实验反思:小周在做实验的时盛放待测盐酸的烧杯(实验步骤中加点的烧杯)在装入盐酸前内壁附着较多水,用该烧杯完成上述实验会导致结果_______(填“偏大”“偏小”或“无影响”)。
数据处理:计算该盐酸溶液的溶质质量分数_______________。