题目内容
【题目】同学们运用对比的学习方法探究碱的性质。
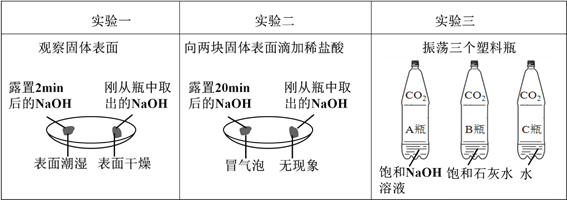
①由上图实验一、二可知,氢氧化钠会吸收空气的______________,因此要密封保存。
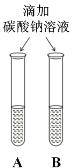
②实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C, A瓶内发生反应的化学方程式为_____________________,对比A瓶与____________(选填“B”或“C”)瓶的实验现象可证明CO2 能与NaOH发生反应。
③同学们设计如下两种方案鉴别氢氧化钠溶液与饱和氢氧化钙溶液(编号为A、B)。
方案一 | 方案二 | 分析 |
| 微热(不考虑水分蒸发) | 两种方案中均观察到A试管内出现白色浑浊,A中试剂为____________; 方案二的设计原理是利用了_____________。 |
【答案】 H2O 和CO2 2NaOH + CO2= Na2CO3+ H2O C 氢氧化钙溶液 氢氧化钙的溶解度随温度升高而减小
【解析】由上图实验一、二可知,氢氧化钠会吸收空气的水分散潮解,与二氧化碳反应生成碳酸钠而变质,因此要密封保存;②三个软塑料瓶变瘪的程度大小为A>B>C,即氢氧化钠吸收的二氧化碳的最多,水吸收二氧化碳的最少;氢氧化钠和二氧化碳发生反应的化学方程式为2NaOH + CO2 = Na2CO3 + H2O ;对比装有氢氧化钠溶液的A瓶与只装有水的C瓶,A变瘪的程度远大于C变瘪的程度,实验现象可证明CO2 能与NaOH发生反应;③方案一生成白色沉淀是由于氢氧化钙与碳酸钠反应生成的,A中试剂为和氢氧化钙溶液;方案二是由于氢氧化钙的溶解度随温度的升高而减小的原理;

练习册系列答案
相关题目