题目内容
【题目】(1)实验探究小组的同学欲利用下列仪器验证某混合气体可能含有H2、CO、H2O、HCl中的一种或几种组成。
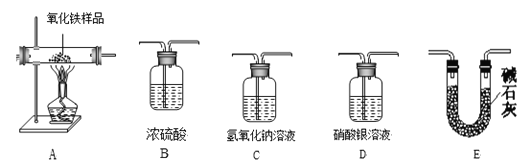
(实验设计) 所选仪器的连接顺序为:混合气体→D→B1→A→B2→C→E(B1、B2均为盛装浓硫酸的试剂瓶)。
(实验及数据)样品充分反应(假设每步均反应完全),并测定部分装置反应前后的质量变化,数据如下:
装置编号 | D | B1 | B2 | C |
试剂 | 硝酸银溶液 | 浓硫酸 | 浓硫酸 | 氢氧化钠溶液 |
现象或质量变化 | 无明显现象 | 增重1.0g | 无增重 | 增重6.6g |
请回答下列问题:
①装置A中能观察到的明显现象是___________________________________;
②装置D的作用是_________________________________;
③根据表格中的现象和数据判断,混合气体中一定不存在的气体是___________;无法确定是否存在的气体是___________,要验证该气体是否存在,应如何改进实验设计______________________________________________;
④从环境保护的角度考虑,针对该套实验装置不足提出改进建议 ____________________。
(2)“84”消毒液在日常生活中使用广泛,化学兴趣小组对一瓶敞口久置的“84”消毒液成分产生兴趣,展开探究。
(查阅资料)“84”消毒液主要成分是次氯酸钠(NaClO)和氯化钠,NaClO为有效成分,有腐蚀性并易与空气中CO2反应(2NaClO+CO2+H2O═2HClO+Na2CO3)。NaClO溶液、HClO都具有漂白、杀菌、消毒功效,HClO不稳定,受热或光照会发生分解。
(分析讨论)小组同学经过讨论,认为该消毒液中的溶质一定有_______,可能还有NaClO、Na2CO3、HClO中的一种或多种。
(实验过程)大家对可能存在的溶质继续进行以下探究:
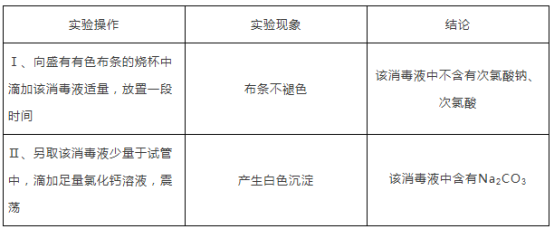
实验步骤 | 实验现象 | 实验结论 |
1.取适量的该消毒液于试管中,放入有色布条 | 布条长时间不褪色 | ___________ |
2. _____________________ | 生成白色沉淀 | 该消毒液中含有Na2CO3 |
(交流反思)“84”消毒液贮藏时应注意密封保存,其原因可能是____________________。
(拓展延伸)日常生活中“84”消毒液不能与洁厕灵(主要成分为盐酸)混合使用,因为二者混合生成氯化钠、水及有毒的氯气,写出该反应的化学方程式______________________。
【答案】红棕色粉末变黑色 检验是否含有HCl气体 HCl、H2 H2O 在装置D前再增加一个盛浓硫酸的试剂瓶并称重(或装置D前增加一个无水硫酸铜的干燥管) 在E装置后对尾气进行点燃(合理即可) NaCl 取少许该消毒液于试管中,滴加氯化钙溶液(合理即可) 消毒液中不含NaClO、HClO 有效成分易变质 NaClO+2HCl=NaCl+H2O+Cl2↑
【解析】
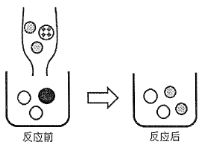
(1)①装置A中是氧化铁发生还原反应的实验装置,能观察到的明显现象是红色的氧化铁颗粒逐渐变成了黑色;;
②氯化氢气体与硝酸银反应会有白色沉淀生成。装置D的作用是检验是否含有HCl气体;
③由于硝酸银溶液中没有沉淀生成,B2中浓硫酸没有增重,可推导,混合气体中一定不存在的气体是HCl、H2;无法确定是否存在的气体是H2O,要验证该气体是否存在,应如何改进实验设计:在装置D前再增加一个盛浓硫酸的试剂瓶并称重(或装置D前增加一个无水硫酸铜的干燥管);
④该实验没有尾气处理装置,从环境保护的角度考虑,针对该套实验装置不足提出改进建议在E装置后对尾气进行点燃;
(2)[分析讨论]因为“84”消毒液主要成分是次氯酸钠(NaClO)和氯化钠,氯化钠的化学性质稳定,所以该消毒液中的溶质一定有氯化钠;故填:NaCl;
[实验过程]
Ⅰ、向盛有有色布条的烧杯中滴加该消毒液适量,放置一段时间,布条不褪色,说明该消毒液中不含有次氯酸钠、次氯酸;
Ⅱ、另取该消毒液少量于试管中,滴加足量氯化钙溶液,震荡,产生白色沉淀,是因为氯化钙和碳酸钠反应生成了碳酸钙沉淀和氯化钠,实验过程如下所示:
[交流反思]NaClO有腐蚀性并易与空气中CO2反应,HClO不稳定,受热或光照易分解,因此生活中,“84”消毒液应该密封、低温避光保存,故填:有效成分易变质;
[拓展延伸]日常生活中“84”消毒液不能与洁厕灵(主要成分为盐酸)混合使用,因为二者混合生成氯化钠、水及有毒的氯气,写出该反应的化学方程式NaClO+2HCl=NaCl+H2O+Cl2↑。