题目内容
【题目】氢氧化钠与二氧化碳反应再探究。
(实验过程)
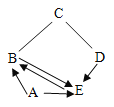
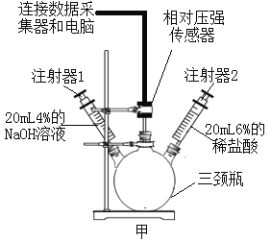
(1)如图甲所示,三颈瓶内集满CO2气体,将两支注射器(两种溶液的密度都约为1.0gmL)和相对压强传感器分别通过橡皮塞固定到三颈瓶上,打开相对压强传感器并和数据采集器和电脑连接。
(2)用夹子固定注射器2的活塞,防止注射器内盐酸被吸入颈瓶内。将注射器内的氢氧化钠溶液全部注入三颈瓶中,充分振荡装置,直至压强不再改变为止。
(3)取下子,将注射器2中酸全部压进三颈瓶中,充分振荡,直至压强不再改变。
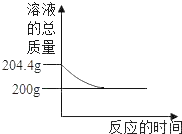
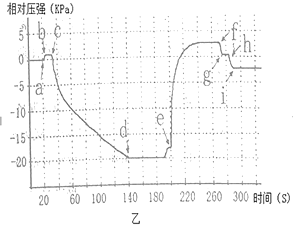
(4)将两个注射器的活塞都拉回原位,并用夹子固定。实验中测得相对压强变化曲线如图乙所示。
(实验分析)
(1)氢氧化钠与二氧化碳反应的方程式为___________。
(2)曲线ef段压强变大的原因是________________。
(3)由线cd、ef段分别从______________角度和新物质生成角変证明了氢氧化能与二氧化碳反应。
(4)曲线在i点之后的相对压强小于0且保持稳定的原因可能是_________________。
a 少量CO2溶于水 b 稀盐酸量不足 c 装置漏气
【答案】2NaOH +CO2=Na2CO3 +H2O 二氧化碳与氢氧化钠反应产生的碳酸钠与稀盐酸发生反应,生成了二氧化碳气体,三颈瓶中气体增多,压强变大 三颈瓶内压强变化 a
【解析】
(1) 氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的方程式为:2NaOH +CO2=Na2CO3 +H2O
(2) 将注射器2中盐酸全部压进三颈瓶中,二氧化碳与氢氧化钠反应产生的碳酸钠与稀盐酸发生了反应,生成二氧化碳气体,三颈瓶中气体增多,压强变大。
(3) 曲线cd、ef段分别从三颈瓶内压强变化的角度和新物质生成角度证明了氢氧化钠和二氧化碳反应。
(4) a.少量CO2溶于水使得装置内压强变小,小于0,此选项符合题意;b.稀盐酸量不足,不可能先达到0,然后又降低,此选项不符合题意;c.装置漏气应该与装置内的起始压强相等,为0,此选项不符合题意。故选a。

【题目】实验室中的药品一般要密封保存,否则可能会与空气接触而变质.某研究性学习小组的同学对实验室里久置于空气中变质的过氧化钠(Na2O2)固体的成分进行探究.
(查阅资料)(1)Na2O2的化学性质很活泼,能与水、二氧化碳反应,相关反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2↑;
(2)CaCl2溶液为中性。
(提出问题)固体物质的成分可能为:
①:固体为Na2O2、NaOH、Na2CO3的混合物
②:固体为NaOH和Na2CO3的混合物
③:固体为NaOH
④:固体为Na2CO3
(实验探究)
实验操作 | 实验现象 | 实验结论 |
①取少量固体于试管中,加水振荡,直至完全溶解 | _____ | 猜想①不成立 |
②取少量①的溶液于试管中,滴加CaCl2溶液至过量 | _____ | 证明有Na2CO3存在 |
③ 取少量②的溶液于试管中,滴加几滴酚酞试液 | _____ | 证明有NaOH存在 |
综合以上实验现象,说明猜想II是成立的. | ||
(反思评价)
(1)实验操作②中反应的化学方程式为_____.
(2)实验操作②中“滴加CaCl2溶液至过量”的目的是_____.