题目内容
【题目】综合化学计算,在烧杯中加入2.14g久置的铝箔(只含两种物质),再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示。请回答下列问题:
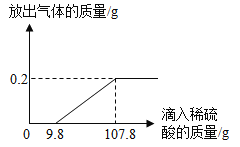
(1)产生氢气的质量是_____g,刚开始滴加稀硫酸没有氢气放出的原因是_____(用化学方程式表示)。
(2)与生成氢气有关的稀硫酸溶液的质量为_____(只写计算结果)。
(3)所滴加的稀硫酸中溶质的质量分数。_____(请写出计算过程)
(4)铝箔中铝元素的质量为_____。
【答案】0.2g ![]() 98g 设生成0.2g H2需要H2SO4的质量为x,需要铝的质量为y,则有:
98g 设生成0.2g H2需要H2SO4的质量为x,需要铝的质量为y,则有:
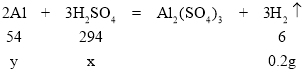
由![]()
解得x=9.8g,y=1.8g
所滴加的稀硫酸中溶质的质量分数为![]() ;
;
答:所滴加的稀硫酸中溶质的质量分数为10%。 1.98g
【解析】
(1)由题意,久置的铝箔表面有致密的氧化铝膜,加入稀硫酸此氧化膜与硫酸反应生成硫酸铝和水,不生产氢气,氧化铝反应完之后,铝与稀硫酸反应生成硫酸铝和氢气,根据图示关系可知,产生氢气的质量为0.2g;氧化铝与硫酸反应的化学方程式为![]() 。
。
(2)由坐标图可知与生成氢气有关的稀硫酸溶液的质量为![]() 。
。
(3)设生成0.2g H2需要H2SO4的质量为x,需要铝的质量为y,则有:
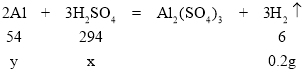
由![]()
解得x=9.8g,y=1.8g
所滴加的稀硫酸中溶质的质量分数为![]() ;
;
答:所滴加的稀硫酸中溶质的质量分数为10%。
(4)根据第三步中的计算,铝箔中Al2O3的质量为![]() ,则氧化铝中铝元素的质量为
,则氧化铝中铝元素的质量为![]() ,故铝箔中铝元素的质量为
,故铝箔中铝元素的质量为![]() 。
。

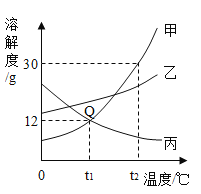
【题目】如图所示,在分别盛有100g水的烧杯中放入KNO3充分溶解,则说法正确的是( )
温度(℃) | t1 | t2 |
KNO3的溶解度(g/100g水) | 60 | 90 |
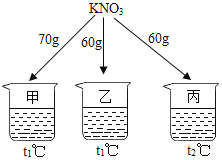
A. 甲、乙混合后为t1℃的不饱和溶液
B. 乙升温至t2℃,溶液质量增加
C. 乙、丙溶液中溶质质量相等
D. 丙降温至t1℃,有晶体析出
【题目】黄铜是铜和锌的合金,取一定质量的黄铜样品放入烧杯中,缓慢滴加足量盐酸溶液,合金与盐酸溶液反应的情况和实验数据如下,下列说法错误的是( )
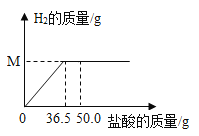
反应前 | 反应后 | ||
实验数据 | 盐酸溶液的质量 | 烧杯和黄铜样品的质量 | 烧杯和剩余物的质量 |
50.0g | 63.0g | 112.9g | |
A.生成氢气的质量M为0.1g
B.反应后所得溶液的pH小于7
C.所用盐酸溶液的溶质质量分数为10.0%
D.黄铜样品的质量为13.0g
【题目】向碳酸氢镁[Mg(HCO3)2]溶液中加入一定量NaOH溶液,出现白色沉淀。某化学兴趣小组同学对该白色沉淀作如下探究:
(查阅资料)I.Mg(OH)2是一种难溶于水的白色固体,MgCO3是一种微溶于水的白色固体。
Ⅱ.Mg(OH)2、MgCO3受热均易分解,分别生成对应的两种氧化物。
Ⅲ.无水硫酸铜是一种白色固体,遇水变蓝。
(作出猜想)猜想一:只有Mg(OH)2;猜想二:只有MgCO3:;猜想三:_____。
(实验1)
步骤 | 实验操作 | 实验现象 | 实验结论 |
步骤1 | 取适量白色固体,加入足量的稀盐酸 | 有气泡产生 | 猜想_____不成立 |
步骤2 | 另取适量白色固体,充分加热,将产生的气体通入盛有无水硫酸铜的U形管 | _____ | 猜想二不成立 |
小张查阅资料得知上述固体是碱式碳酸镁[XMgCO3yMg(OH)23H2O],它不溶于水,受热易分解。
(实验2)
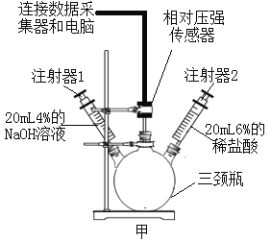
为进一步确定白色固体的组成,小张取一定量白色固体,按下图装置加热至固体质量不再改变,并测定各生成物的质量。
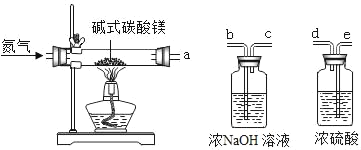
(1)反应结東后若没有继续通一会儿氮气就直接称量洗气瓶的质量,则测得的气体质量将_____(填:“偏大”、“偏小”或“不变”)
(2)为测定各生成物的质量,导管口的连接顺序为a→_____,_____→_____(填字母)。
(3)实验数据:加热完全后剩余固体质量3.20g;浓NaOH溶液增重2.64g;浓硫酸增重1.44g则:x:y=_____。
(拓展延伸)
碱式碳酸镁可作阻燃剂,其可能的原因是_____(选填字母)。
a生成的固体覆盖在燃烧物表面,隔绝氧气
b分解时吸热,使温度难以达到可燃物的着火点
c生成的气体降低了可燃物周围的氧气浓度