题目内容
【题目】小组在用盐酸和大理石制取二氧化碳时,发现产生气泡的速率不一样,同学们展开了探究.所用盐酸浓度为10%、20%,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、30℃,每次实验盐酸的用量为100mL、大理石用量为10.0g.
【提出问题】盐酸与大理石反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸浓度有关;b.可能与温度有关;c.可能与大理石规格有关
(1)【设计并实验】
请完成以下实验设计表,并在实验目的一栏中填写对应的实验编号.
实验 | 温度(℃) | 大理石 | 盐酸浓度(均取100mL) | 实验目的 |
① | 20 | 粗颗粒 | 20% | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; |
② | 20 | 粗颗粒 | 10% | |
③ | 细颗粒 | 20% | ||
④ | 粗颗粒 |
请写出大理石与盐酸反应的化学方程式
(2)【数据整理】实验①中CO2质量随时间变化的关系如图.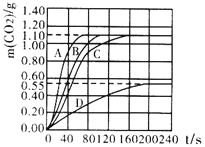
【分析数据】
以上图形中有四条曲线,其中实验③对应的曲线为B,即③﹣B.请写出能反映其它三组实验对应的曲线 , , .
(3)【拓展】
以上方法是通过测量产生气体快慢来判断化学反应的快慢,还可以借助其它反应现象来判断反应的快慢,你认为是 .
【答案】
(1)④;③;CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)④﹣A;①﹣C;②﹣D
(3)固体减少的快慢
【解析】解:实验目的是探究浓度、温度、接触面积对反应速率的影响,故:(Ⅰ)由于①和②探究浓度对反应速率的影响,故稀盐酸的浓度不同,应该是20%;(Ⅱ)实验①和④探究温度对该反应速率的影响,故温度不同,应该选30℃,所以答案是:④;
(Ⅲ)实验①和③的大理石规格不同,探究的是固体物质的表面积对反应速率的影响,所以答案是:③;
所以答案是:(1)
实验 | 温度(℃) | 大理石规格 | HCl浓度 | 实验目的 |
① | 20 | 粗颗粒 | 20% | (Ⅰ)实验①和②探究HCl浓度对该反应速率的影响; |
② | 20 | 粗颗粒 | 10% | |
③ | 20 | 细颗粒 | 20% | |
④ | 30 | 粗颗粒 | 20% |
CaCO3+2HCl=CaCl2+H2O+CO2↑;(2)根据反应的快慢可以确定同浓度温度越高,反应越快.同温度,浓度高反应快.同温度同浓度表面积越大反应越快.故④﹣A;①﹣C;②﹣D.(3)判断判断化学反应的快慢,可以从气泡的快慢,也可以从固体减少的快慢.所以答案是固体减少的快慢.
【考点精析】本题主要考查了书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握注意:a、配平 b、条件 c、箭号才能正确解答此题.