��Ŀ����
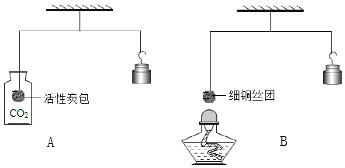
����Ŀ��ijУ��ȤС��ͬѧ�����г����ᡢ��ε�����ʵ��ʱ������ʵ��̨�ϰڷŵ�ҩƷ�У���ͼ������һװ��Һ���Լ�ƿδ��ƿ���ұ�ǩ�������Ǿ�������ƿ��Һ����ʵ��̽����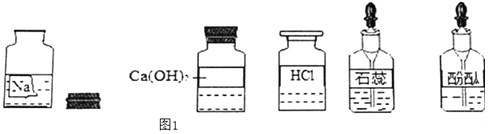
��������⣩��ƿ��Һ��ʲô��Һ��
�������Ϣ���ᡢ�������ʵ�����õ�������Ԫ�ص��������Ȼ��ơ��������ơ�̼���ơ�
��������룩��ƿ��Һ�����ǣ�1���Ȼ�����Һ��2������������Һ��3��̼������Һ��
��ʵ���ƶϣ���1��С��ȡ���μ���ɫ��̪��Һ����Һ�ʺ�ɫ���ó����ۣ�����Һ��������______��Һ��������______��
��2��С����ȡ���μ�ϡ������______��������Ӧ�Ļ�ѧ����ʽΪ______��С�յó����ۣ�����Һ��̼������Һ��
��3��С����ΪС�յĽ��۲���ȫ��ȷ������______��
С��ͬѧ���ۺ�һ����Ϊ����Ҫ��������ʵ�飺
��4��������̽������ȡ�����������CaCl2��Һ���ɹ۲쵽��______��������Ӧ�Ļ�ѧ����ʽΪ______�������һ�����Ŀ����______�����ú�ȡ�ϲ���Һ�������̪��Һ����Һ�ʺ�ɫ��
��5����ʵ����ۣ���ƿ��Һ���ԭ������______��
��6������˼������С�յ�ʵ������в�����ɵĶ�����̼����������������֮��Ĺ�ϵ��ͼ��ʾ��Ϊʲô�տ�ʼû������ð�������û�ѧ����ʽ��ʾ��______��A��ʱ��Һ�е�������______��

��7����127g����������Һ��73g��������Ϊ20%������ǡ����ȫ�кͣ��Լ��㷴Ӧ��������Һ�����ʵ���������Ϊ______��
���𰸡��Ȼ��� �Ȼ�����Һ�����ԣ�����ʹ��̪��Һ��ɫ ���� Na2CO3+2HCl=2NaCl+H2O+CO2�� ���ʵ�����������Һ�к���̼���� ��ɫ���� Na2CO3+CaCl2=CaCO3��+2NaCl ��ȥ̼���ƣ���ֹ�Լ����������Ʋ���Ӱ�� �������� NaOH+HCl=NaCl+H2O ̼���ơ��Ȼ��� 11.7%
��������
��1������Һ���������Ȼ�����Һ���������Ȼ�����Һ�����ԣ�����ʹ��̪��Һ��ɫ��
��2��С�յó����ۣ�����Һ��̼������Һ��̼���ƺ�ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��������Һ��̼������Һ��С����ȡ���μ�ϡ���������ݲ�������Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+2HCl=2NaCl+H2O+CO2����
��3�����������ڿ����������ն�����̼����̼���ƺ�ˮ�����ʡ�С����ΪС�յĽ��۲���ȫ��ȷ�������DZ��ʵ�����������Һ�к���̼���ƣ�
��4��̼���ƺ��Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ơ���ȡ�����������CaCl2��Һ���ɹ۲쵽�а�ɫ������������Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+CaCl2=CaCO3��+2NaCl�������һ�����Ŀ���ǣ���ȥ̼���ƣ���ֹ�Լ����������Ʋ���Ӱ�죬���ú�ȡ�ϲ���Һ�������̪��Һ����Һ�ʺ�ɫ��˵����Һ�к����������ƣ�
��5����ƿ��Һ���ԭ�������������ƣ�
��6���տ�ʼû������ð��������Ϊϡ�����Ⱥ��������Ʒ�Ӧ�����Ȼ��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��NaOH+HCl=NaCl+H2O��A��ʱ��Һ�е�������û�з�Ӧ��̼���ƺͷ�Ӧ���ɵ��Ȼ��ƣ�
��7���跴Ӧ�����Ȼ�������Ϊx��
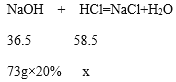
![]() =
=![]() x=23.4g��
x=23.4g��
��Ӧ��������Һ�����ʵ���������=![]() ��100%=11.7%��
��100%=11.7%��

 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�����Ŀ������� NaCl��NH4Cl �ڲ�ͬ�¶�ʱ���ܽ�ȡ�
�¶�/�� | 0 | 20 | 40 | 60 | 80 | |
�ܽ��/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | |
��1�������������ʵ��ܽ�����¶�Ӱ��ϴ����_____��
��2��40��ʱ���� 40.6g NaCl ���뵽 100g ˮ�У���ֽ���ʹ֮�ܽ⣬������Һ������Ϊ_____g��
��3��20��ʱ��NaCl ������Һ��������������Ϊ����ȷ��С����� 1 λ��_____��