题目内容
【题目】兴趣小组获得两包制作“跳跳糖”的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了使澄清石灰水变浑浊的气体。于是对白色粉末的化学成分进行了以下探究。
(提出猜想)猜想1.碳酸钠;
猜想2.碳酸氢钠;
猜想3.碳酸钠和碳酸氢钠。
(查阅资料)①碳酸钠溶液、碳酸氢钠溶液均呈碱性;
②碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,碳酸钠受热不分解。
(实验探究)小月、小妮分别对有关猜想设计方案并进行实验:
实验操作 | 实验现象 | 实验结论 | |
小月 | 将白色粉末溶于水后用pH试纸测定其酸碱度 | pH_____7 | 溶液呈碱性,猜想1成立 |
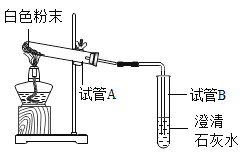
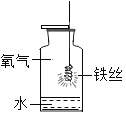
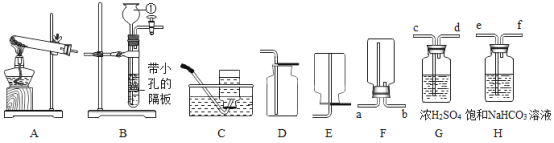
小妮 | 用图所示的装置进行实验
| 试管A中有水珠产生,试管B中液体变浑浊 | 猜想2成立,试管A中反应的化学方程式为_____ |
(交流反思)大家一致认为小月和小妮的结论不准确。
(1)小月的实验结论不准确的原因是_____;若用事先用水润湿的pH试纸测溶液的酸碱度,则测得的pH值_____(选填“偏大”、“偏小”或“不变”)。
(2)小妮的实验方案不能排除白色粉末是否含有_____。
(继续探究)小威称取10g白色粉末与足量稀盐酸反应,充分反应后生成二氧化碳的质量为ng,通过计算并分析实验数据确定猜想3正确,则n的取值范围为_____(保留一位小数)。
(结论分析)探究后他们核查到添加剂的成分是柠檬酸和碳酸氢钠,分析后认为白色粉末中的碳酸钠是由碳酸氢钠分解产生的。
(拓展应用)下列物质常温下放置一段时间也会分解的是_____(填序号)。
A 浓硫酸 B 氢氧化钠 C 碳酸氢铵 D 氯化钠
【答案】pH>7 2NaHCO3![]() Na2CO3+H2O+CO2
Na2CO3+H2O+CO2![]() 碳酸钠溶液、碳酸氢钠溶液均呈碱性,都会使测出的PH>7。 偏小 碳酸钠
碳酸钠溶液、碳酸氢钠溶液均呈碱性,都会使测出的PH>7。 偏小 碳酸钠 ![]() C
C
【解析】
实验探究:根据资料①碳酸钠溶液、碳酸氢钠溶液均呈碱性,所以小月测出的pH>7;小妮的实验中,试管A中有水珠产生,证明有水生成,试管B中澄清石灰水变浑浊,说明产生了CO2,根据资料②碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,碳酸钠受热不分解,说明白色晶体中含有的碳酸氢钠受热分解,试管A中反应的方程式为:2NaHCO3![]() Na2CO3+H2O+CO2
Na2CO3+H2O+CO2![]() 。故答案为:pH>7;2NaHCO3
。故答案为:pH>7;2NaHCO3![]() Na2CO3+H2O+CO2
Na2CO3+H2O+CO2![]() 。
。
交流反思:(1)小月的实验结论不准确,因为资料①碳酸钠溶液、碳酸氢钠溶液均呈碱性,所以猜想1.碳酸钠、猜想2.碳酸氢钠、猜想3.碳酸钠和碳酸氢钠,都会使测出的pH>7;若用事先用水润湿的pH试纸测溶液的酸碱度,相当于把被测溶液稀释,则碱性减弱,pH会偏小。
故答案为:碳酸钠溶液、碳酸氢钠溶液均呈碱性;偏小。
(2)小妮的实验现象虽然看到有水雾和澄清石灰水变浑浊现象,证明有碳酸氢钠的存在,它反应生成水、二氧化碳的同时还生成碳酸钠,不能证明原来白色粉末中是否含碳酸钠。
故答案为:碳酸钠。
继续探究:小威称取10g白色粉末与足量稀盐酸反应,充分反应后生成二氧化碳的质量为ng,如果把10g白色粉末全部看作碳酸氢钠,则根据化学方程式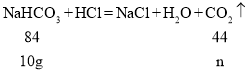 , 列比例式解得:n=
, 列比例式解得:n=![]() ;如果把10g白色粉末全部看作碳酸钠,则根据化学方程式
;如果把10g白色粉末全部看作碳酸钠,则根据化学方程式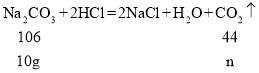 ,列比例式解得:n=
,列比例式解得:n=![]() 。所以如果猜想3正确,碳酸钠与碳酸氢钠都有,则n的取值范围为
。所以如果猜想3正确,碳酸钠与碳酸氢钠都有,则n的取值范围为![]() 。
。
故答案为:![]() 。
。
拓展应用:碳酸氢铵在空气中放置一段时间后会分解为氨气、水、二氧化碳,浓硫酸、氢氧化钠、氯化钠在常温下放置是不会分解的的。
故答案为:C。

【题目】学习化学常用的方法有分类、类比等。
(1)初中化学许多实验,按其主要目的分为:探究物质的性质、混合物的分离提纯、探究物质的含量等。据此应将下列实验中的D与________(填“A”或“B”或“C”)归为一类,依据是________。
|
|
|
|
A | B | C | D |
(2)装饰材料通常会释放出一种有害气体甲醛,其实醛类是一类物质,甲醛化学式为HCHO,乙醛化学式为CH3CHO,丙醛化学式为CH3CH2CHO,请你写出丁醛的化学式(含有四个碳原子)________,甲醛燃烧产物与甲烷相似,写出甲醛燃烧的化学方程式________。