题目内容
【题目】(13分)糕点疏松剂的主要成分中有碳酸氢钠。某化学兴趣小组的同学对碳酸氢钠的性质进行了探究。
Ⅰ.定性探究
实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH约为10,可知碳酸氢钠溶液呈 性。
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳和一种常
见的固体物质。
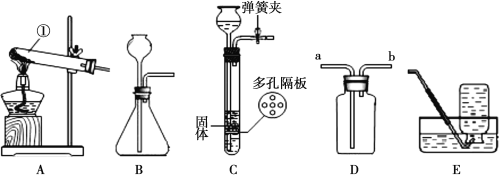
【实验1】取一定质量的碳酸氢钠放到铜片上加热,如图所示。

(1)加热一段时间后,观察到烧杯内壁有水珠。
(2)充分加热后, 将烧杯迅速倒转过来,倒入适量的澄清石灰水,
振荡,观察到石灰水变浑浊。
(3)欲通过进一步的实验探究来确定充分加热后的固体产物的成分。
【提出假设】①可能是Na2CO3 ②可能是NaOH ③可能是NaOH和Na2CO3
【实验2】
实验操作 | 实验现象 | 实验结论 |
A.将该固体溶于蒸馏水配制成溶液,取少量溶液于试 管中,滴加足量稀盐酸 | 有气体产生 | 假设 (填序号)不成立 |
B.另取少量溶液于试管中,滴加足量氯化钡溶液 |
| 固体产物中有 Na2CO3 |
C.取上述B步骤静置后所得上层清液,滴入少量酚酞 溶液 | 无明显现象 | 固体产物中 |
【实验结论】NaHCO3受热分解的化学方程式为 。
Ⅱ.定量探究
为测定某疏松剂中碳酸氢钠的质量分数,设计了如下实验,其主要实验步骤如下:
①按下图组装仪器,取50.0g样品放入锥形瓶中,加入足量稀硫酸溶液;②测量一定时间内干燥管内碱石灰(氧化钙和氢氧化钠固体的混合物)增加的质量(见下图曲线);③待锥形瓶中不再产生气泡时,关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量的空气;④再次称量干燥管内物质增加的质量;⑤重复步骤③和④的操作,直至干燥管内物质质量不变。
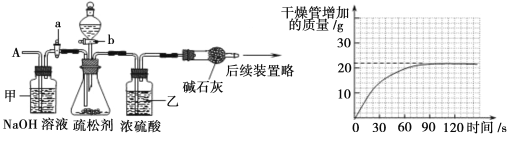
(1)步骤①加入样品前还应 。
(2)装置乙的作用是 ;实验步骤③中,甲装置的作用是 。
(3)请利用相关数据计算样品中碳酸氢钠的质量分数。(写出计算过程)
【答案】 Ⅰ.定性探究 实验一:碱 实验二:② 有白色沉淀产生 没有氢氧化钠 2NaHCO3![]() Na2CO3+CO2↑+H2OⅡ.定量探究 (1)检查装置的气密性 (2)吸收二氧化碳中混有的水蒸气 吸收鼓入空气中的二氧化碳(3)84%
Na2CO3+CO2↑+H2OⅡ.定量探究 (1)检查装置的气密性 (2)吸收二氧化碳中混有的水蒸气 吸收鼓入空气中的二氧化碳(3)84%
【解析】
试题分析:Ⅰ.定性探究 实验一:用pH试纸测得碳酸氢钠溶液的pH约为10,根据溶液的酸碱性与pH的关系,可知碳酸氢钠溶液呈碱性;实验二:【实验2】A.将该固体溶于蒸馏水配制成溶液,取少量溶液于试
管中,滴加足量稀盐酸,有气泡产生,说明样品中含有碳酸钠,故假设②不成立;B.另取少量溶液于试管中,滴加足量氯化钡溶液,有白色沉淀产生,说明含有碳酸钠,C.取上述B步骤静置后所得上层清液,滴入少量酚酞溶液,无明显现象,说明固体中没有氢氧化钠,【实验结论】NaHCO3受热分解的化学方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O;Ⅱ.定量探究(1)步骤①加入样品前还应检查装置的气密性,(2)因为装置乙中试剂为浓硫酸,故其作用是吸收二氧化碳中混有的水蒸气,实验步骤③中,甲装置的作用是吸收鼓入空气中的二氧化碳,防止出现较大误差
Na2CO3+CO2↑+H2O;Ⅱ.定量探究(1)步骤①加入样品前还应检查装置的气密性,(2)因为装置乙中试剂为浓硫酸,故其作用是吸收二氧化碳中混有的水蒸气,实验步骤③中,甲装置的作用是吸收鼓入空气中的二氧化碳,防止出现较大误差
(3)解:分析坐标,生成二氧化碳的质量为22g,
设样品中碳酸氢钠的质量为x。
2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O
168 88
x 22g
168∶88 =x∶22g
x =42g (2分)
样品中碳酸氢钠的质量分数为42g /50g ×100%=84% (1分)
答:样品中碳酸氢钠的质量分数为84%