题目内容
水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用.
(1)自来水的生产过程大体如下图:
上图过滤池中有活性炭层,活性炭起 作用,该过程中发生 变化.氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸.实验室配制AgN03溶液时不宜使用自来水,其原因是(用化学方程式表示) .高铁酸钾(K2Fe04)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是 .
(2)电解水时,加入少量NaOH可以增强水的导电性.现将0.1gNaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是 ,当溶液中NaOH的质量分数变为0.2%时,有 水被分解.
(3)在河旁有甲、乙、丙、丁四座工厂(位置如图所示),每个工厂排出的废液只含有Na2C03、FeCl3、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是 .
②乙处河水呈红褐色的化学方程式是 .
③丁处产生气泡的化学方程式是 .
(4)保护水资源,我们应该采取的措施是 .
(1)吸附;物理;AgN03+HCl=AgCl+HNO3;+6;(2)O2;50.0g;(3)①酚酞或石蕊;②3NaOH+FeCl3=Fe(OH)3↓+3NaCl;③Na2C03+2HCl=2NaCl+C02+H20;(4)工业生产中减少甚至消除水体污染物的产生(或农业生产中使用高效低毒的农药、化肥生活中推广使用无磷洗衣粉对污水集中处理,达标后排放)(只要答对一点即可).
解析试题分析:(1)活性炭具有吸附性,在水的净化过程中起到吸附作用,过程中没有新物质产生属于物理变化;硝酸银与盐酸发生复分解反应,生成氯化银沉淀和硝酸,反应的化学方程式为AgN03+HCl=AgCl+HNO3;根据化合物中各元素化合价代数和为零,高铁酸钾(K2Fe04)中铁元素的化合价=0﹣(+1)×2﹣(﹣2)×4=+6;(2)电解水时与电源正极相连的一端放出的气体是氧气;当溶液中NaOH的质量分数变为0.2%时,剩余溶液的质量=0.1g÷0.2%=50g,其中溶剂水的质量=50g﹣0.1g=49.9g;则被分解水的质量=99.9g﹣49.9g=50.0g;(3)①利用酚酞遇碱性溶液变红或石蕊遇碱性溶液变蓝的特点,可选用这两种试剂对该处水的碱性进行检验;②乙处河水呈红褐色,可判断此时产生了氢氧化铁的红褐色沉淀物,根据题设信息“废液只含有Na2C03、FeCl3、NaOH、HCl中的一种”,则该处发生反应为氯化铁与氢氧化钠反应生成氢氧化铁,反应的化学方程式为
3NaOH+FeCl3=Fe(OH)3↓+3NaCl;③根据题设信息,可判断丁处产生气泡是由于碳酸钠与盐酸反应放出二氧化碳的结果,反应的化学方程式为Na2C03+2HCl=2NaCl+C02↑+H20;(4)工业污水的排放、农业生产中农药化肥的不合理使用、生活污水的随意排放都是导致水被污染的主要原因,因此采取措施避免以上行为则可起到保护水资源的目的,即工业生产中减少甚至消除水体污染物的产生(或农业生产中使用高效低毒的农药、化肥生活中推广使用无磷洗衣粉对污水集中处理,达标后排放).
考点:自来水的生产过程与净化方法;水资源的污染与防治;有关元素化合价的计算;书写化学方程式、文字表达式、电离方程式.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案水是生命之源,也是人类最宝贵的资源。
(1)自然界中的水都不是纯水,净水时需加入明矾的目的是 。
(2)欲除去水中不溶性杂质,需进行过滤操作,该操作过程中玻璃棒的作用是 。
(3)若要测定黄浦江水的酸碱度,最适宜的试剂或用品是 (填序号)。
| A.紫色石蕊试液 | B.pH试纸 | C.石灰石 | D.无色酚酞试液 |
(5)“84”消毒液的有效成分NaClO中的氯元素的化合价为 ;Cl2常作自来水消毒剂,其实验室制法为
 , 则X的化学式为 ;此反应中属于氧化物的是 (填化学式),此反应中含有游离态氯元素的物质是 (填化学式)。
, 则X的化学式为 ;此反应中属于氧化物的是 (填化学式),此反应中含有游离态氯元素的物质是 (填化学式)。 

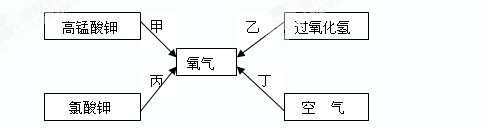

 请回答问题:
请回答问题: