题目内容
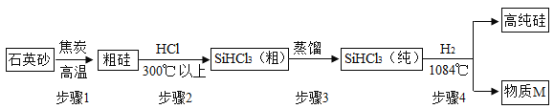
【题目】按如图组装仪器,关闭止水夹,通电使红磷燃烧,请回答下列问题
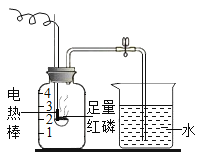
(1)上述实验的燃烧现象为:_____。
(2)冷却后,松开止水夹,你观察到的现象为:_____。
(3)集气瓶燃烧后剩余气体主要是氮气,通过本实验可以得出关于氮气一条化学性质为:_____。
(4)实验完毕后,打开止水夹,发现最终盛 入集气瓶的水的体积小于瓶内空气体积的1/5,试分析其可能的原因为:_____。(写一点即可)
(5)不能用木炭或硫粉代替红磷实验的原因是:_____。
【答案】红磷燃烧,放出热量,冒大量白烟 水倒流入集气瓶中于第一刻度线处 氮气不燃烧且不支持燃烧 红磷量不足(答案合理即可) 木炭或者硫粉燃烧都会产生气体,导致瓶内压强改变较小而不易观察出实验现象且会导致测量结果不准确
【解析】
红磷在氧气中点燃生成五氧化二磷,木炭在氧气中点燃生成二氧化碳,硫在氧气中点燃生成二氧化硫。
(1)红磷燃烧生成五氧化二磷,实验的燃烧现象为红磷燃烧,放出热量,冒大量白烟。
(2)红磷燃烧放出大量热,集气瓶内气体膨胀,压强变大,氧气体积约为空气总体积的五分之一,故冷却后,松开止水夹,观察到的现象为水倒流入集气瓶中于第一刻度线处。
(3)集气瓶燃烧后剩余气体主要是氮气,氮气不燃烧,也没参与燃烧,不溶于水,故通过本实验可以得出关于氮气一条化学性质为:氮气不燃烧且不支持燃烧。
(4)实验完毕后,打开止水夹,发现最终盛 入集气瓶的水的体积小于瓶内空气体积的1/5,其可能的原因为红磷量不足。
(5)不能用木炭或硫粉代替红磷实验的原因是木炭或者硫粉燃烧都会产生气体,导致瓶内压强改变较小而不易观察出实验现象且会导致测量结果不准确。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】兴趣小组的同学按照课本上的实验装置做“空气中氧气含量”的测定实验(如图所示),但测出的氧气的体积分数明显小于![]() .
.
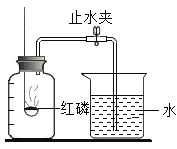
请你参与探究:
(提出问题)造成误差的原因是什么?如何改进课本上的实验装置?
(查阅资料)红磷、白磷的一些性质如下表:
颜色、状态 | 熔点/℃ | 着火点/℃ | 密度/( | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
(猜想与假设)
甲同学:可能是导管内残留有吸入的水,影响实验的准确性。乙同学:可能是装置气密性不好。你还能做出的猜想是________________。
(交流与讨论)
(1)丙同学认为用木炭代替红磷,就可以消除误差,大家认为他的猜想不合理,理由是____________。
(2)他们对课本上的实验装置进行了图所示的改进(其他仪器忽略).
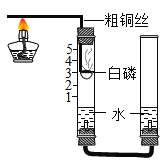
①白磷燃烧的现象__________________(与红磷相同)。
②该实验准确得出了空气中氧气含量的结论。其现象是_____________。
③与课本上的实验装置相比较,该装置的一个优点是______________。
④通过粗铜丝来点燃玻璃管内的白磷,这是利用了金属的____________性。
【题目】氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。

(1)实验一中,B试管中发生反应的化学方程式为________________。A、B两支试管中共同的实验现象是___________________,其原因是_________________。
(2)实验二中,观察到C中有白色沉淀生成,该白色沉淀是___________(填化学式)。
①D试管中无现象,为了探究二氧化碳是否与氢氧化钠反应,甲同学又设计了如图所示的对比实验:

小洪同学认为该实验设计不符合对比实验的基本原则。理由是____________________。
②为了探究D中反应后的溶液中是否有碳酸钠,乙同学进行了如下探究:
方案 | 实验步骤 | 实验现象 | 结论、反应的化学方程式 |
一 | 取少量反应后溶液于一支试管中,加入过量的稀盐酸 | _______________________ | _________________________ |
二 | 取少量反应后溶液于另一支试管中,_________________ | ______________________ | 有碳酸钠生成:____________________ |
③丙同学设计下列实验来证明反应后的溶液中,除生成物碳酸钠还有剩余的氢氧化钠。
实验操作 | 实验现象 | 实验结论 |
取D中少量溶液于另一试管中,加入适量的 | 产生白色沉淀,酚酞试液变红 | 溶液中还有氢氧化钠存在 |
小军评价实验操作③的结论不正确,理由是___________________。