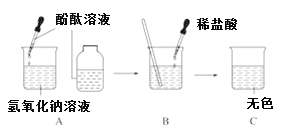
题目内容
【题目】往300g FeCl3、CuCl2的混合溶液中加入铁粉。已知反应的先后顺序和分别为:2FeCl3+Fe=3FeCl2、CuCl2+Fe=FeCl2+Cu.如图为加入铁粉的质量与反应后剩余固体质量关系。则下列说法不正确的是( )
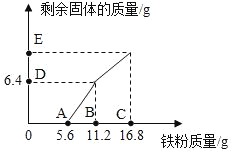
A. 点E对应纵坐标为12.0
B. 该 300g 溶液中的 CuCl2质量分数为6.75%
C. B 点后溶液的颜色为浅绿色
D. 取 DE 两点间的剩余固体加入盐酸,均有气泡产生
【答案】B
【解析】
根据图象可知:0﹣A段是铁与氯化铁反应,A﹣B段是铁与氯化铜反应,B﹣C段的质量=D﹣E段的质量,说明B﹣C段是铁粉剩余进行分析。
A、通过分析可知,A点以前是铁与氯化铁反应,说明与氯化铁反应的铁为5.6g;A﹣B段是铁与氯化铜溶液反应,B﹣﹣C段,铁不再参与反应,6.4g+5.6g=12g,所以点E对应纵坐标为12.0,故A正确;
B、B点处与氯化铜反应铁的质量为11.2g﹣5.6g=5.6g,设参加反应氯化铜的质量为x
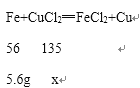
![]() =
=![]()
x=13.5g,所以其溶质的质量分数![]() ×100%=4.5%,故B错误;
×100%=4.5%,故B错误;
C、A点以前是铁与氯化铁反应,说明与氯化铁反应的铁为5.6g;A﹣B段是铁与氯化铜溶液反应,B点后溶液中含有氯化亚铁,故C正确;
D、DE两点间的固体中含有铁、铜,所以取DE两点间的剩余固体加入盐酸,均有气泡产生,故D正确。
故选:B。

 期末冲刺100分创新金卷完全试卷系列答案
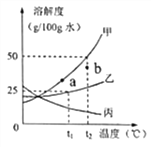
期末冲刺100分创新金卷完全试卷系列答案【题目】根据下列溶解度曲线和A物质的部分温度是的溶解度判断下列说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | A物质 | 20 | 28 | 45 | 60 |
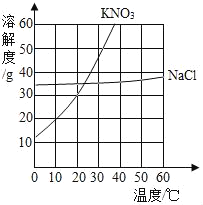
A. 由上图可知,KNO3和NaCl的溶解度均大于A 物质的溶解度
B. 10℃时,将40gNaCl放入50g水中,充分溶解,所得溶液是NaCl的不饱和溶液
C. 将30℃时NaCl、KNO3、和A物质的饱和溶液各降温至10℃,所得溶液的溶质质量分数大小为:KNO3>NaCl>A
D. 20℃时,将KNO3、NaCl和A物质各30g分别配制成恰好饱和溶液,所得溶液的质量大小为A>KNO3=NaCl
【题目】二氧化碳与我们生活息息相关,兴趣小组利用图9装置进行多角度探究。
【资料查阅】(1)浓盐酸具有挥发性,能挥发出氯化氢气体
(2)HCl与AgNO3溶液发生反应,生成白色沉淀(白色沉淀为不溶于水也不溶于酸的AgCl)。
(3)盐酸可与石灰水反应:Ca(OH)2+2HCl═CaCl2+2H2O
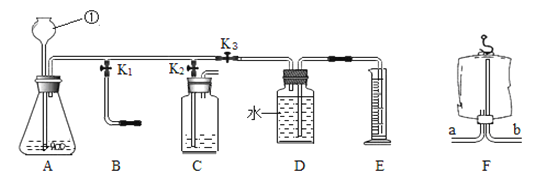
探究一 气体的制取
(1)写出图中①的仪器名称:_____。
(2)用装置A制取二氧化碳的反应化学方程式是_____。若装置A用于实验室制取氧气,则反应化学方程式是_____。
(3)生活中有许多物品可以代替实验仪器。关闭K2和K3,打开K1,若用装置F所示的医用塑料袋排空气法收集CO2,则F装置_____(填“a”或“b”)端与B装置相连。
探究二 气体的性质检验
打开K2、关闭K1和K3,用于检验制取的二氧化碳性质。
(4)若装置C中是紫色石蕊试剂,可观察到_____(填现象),证明二氧化碳与水发生了反应。若装置C中试剂是澄清石灰水,则该反应的化学方程式是_____。
(5)小强将制取的二氧化碳通入澄清石灰水中,未见浑浊,小强认为是使用的盐酸浓度过高,挥发进入石灰水中。要验证是否是上述原因,设计实验方案为:_____。
探究三 测定气体生成的反应速率
关闭K1、K2,打开K3,可测一段时间内生成二氧化碳气体的速率。所测得数据如下:
稀盐酸的体积(mL) (反应前) | 大理石质量(g)(反应前) | E装置收集的液体量(mL) | 反应时间(s) |
50 | 5.0 | 37.8 | 100 |
(6)由实验数据可知,生成CO2的体积为_____ mL。
(7)若生成气体的反应速率用公式v =△V/△t表示(△V表示生成气体的体积、△t表示反应所用的时间),则生成的二氧化碳的速率为_____ mL/s。
(8)有同学认为,图中的测量方法容易带来误差,请指出造成误差的原因_____(写一点)。