题目内容
【题目】某化学兴趣小组的同学发现,不同物质的变化常伴随着相同的实验现象。但从化学的角度去研究,会发现其本质的区别.

(现象分析)
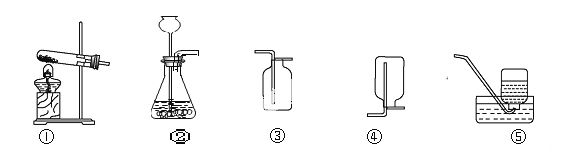
实验一:如图所示向盛有一定量氧化钙固体的试管里加入一定量的水,迅速用带导管的橡皮塞塞紧试管口,并将导管的另一端通入盛有水的试管中,发现A试管的管壁发热,B试管中导管口有气泡冒出.请写出反应的化学方程式_____
实验二:用氢氧化钠固体代替氧化钙重复一次上述实验,同样发现了上述两个实验现象.
(本质归纳)
相同的实验现象,可以由不同的变化引起。
(探究运用)
在探究混合物的成分时,要研究相同实验现象的本质区别.
实验三:有一包白色粉末可能合硫酸钡、碳酸钠、和氢氧化钡中的一种或几种,取一定量的该粉末加入到盛有足量水的烧杯中,搅拌、静置,观察到有白色不溶物.
小刚同学认为,白色粉末中一定含有硫酸钡;
小红同学认为,小刚的结论不准确,其理由可用化学方程式表示为_____针对上述两名同学的观点,小明同学进一步设计如下实验方案进行探究:

(1)步骤③中,滴入酚酰溶液后,若滤液E为红色,则滤液E中除酚酞外还一定含有的溶质是_____(填化学式,下同),由此得出原白色粉末成分组成的结论是_____
(2)小燕同学认为,只需要取少量滤渣B,加入过量的稀盐酸,若看到的现象是白色不溶物部分溶解,且有气泡产生,就足以说明原白色粉末的成分是_____.
【答案】CaO+H2O=Ca(OH)2 Na2CO3+Ba(OH)2=BaCO3↓+2NaOH NaCl、NaOH、BaCl2 Ba(OH)2、Na2CO3 BaSO4、Ba(OH)2、Na2CO3
【解析】
[现象分析]
[现象分析]氢氧化钠溶于水放出热量,氧化钙与水反应会放出热量,会觉得左侧试管外壁发热,观察到右侧试管的导管口处有气泡冒出;氢氧化钠溶于水属于物理变化,而氧化钙与水反应生成氢氧化钙属于化学变化,反应的化学方程式为:CaO+H2O=Ca(OH)2;
[探究运用]碳酸钠与氢氧化钡在溶液反应生成碳酸钡白色沉淀和氢氧化钠;故填:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH;
(1)步骤③中加入酚酞溶液后,若溶液E为红色,说明溶液呈碱性,原混合物中有氢氧化钡,碳酸钠与氢氧化钡反应生成碳酸钡沉淀和氢氧化钠。根据后面加入氯化钡后产生白色沉淀说明碳酸钠较多;则滤液E中除酚酞外还一定含有的溶质是氯化钠、NaOH、BaCl2;
根据现象可知,原混合物可能是氢氧化钡和碳酸钠组成的,也可能是硫酸钡、氢氧化钡和碳酸钠组成的;故填:Ba(OH)2、Na2CO3;BaSO4、Ba(OH)2、Na2CO3;
(2)白色沉淀可能是硫酸钡,也可能是碳酸钡,也可能是硫酸钡与碳酸钡的混合物,其中硫酸钡不与稀盐酸反应,而碳酸钡能与稀盐酸反应生成氯化钡、水和二氧化碳,故取少量滤渣B,加入过量的稀盐酸,若看到的现象是白色不溶物部分溶解,且有气泡产生,就足以说明原白色粉末的成分是BaSO4、Ba(OH)2、Na2CO3;
答案:
[现象分析]CaO+H2O=Ca(OH)2;
[探究运用]Na2CO3+Ba(OH)2=BaCO3↓+2NaOH;
(1)NaCl、NaOH、BaCl2;Ba(OH)2、Na2CO3;
(2)BaSO4、Ba(OH)2、Na2CO3;

【题目】某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。该小组同学进行了如下探究。
(1)写出铁丝在氧气中燃烧的文字表达式:_____。已知铁丝燃烧生成四氧化三铁。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。

由此可知:蜡烛燃烧产生的火焰是由_____(填“固态”或“气态”)物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
(查阅资料)
物质 | 熔点/℃ | 沸点/℃ | 燃烧时温度/℃ |
石蜡 | 50~70 | 300~550 | 约600 |
铁 | 1535 | 2750 | 约1800 |
钠 | 97.8 | 883 | 约1400 |
由上表可知:物质燃烧能否产生火焰与其_____(填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时,_____(填“有”或“没有”)火焰产生。