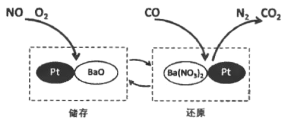
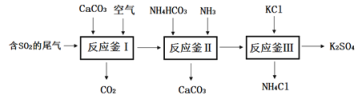
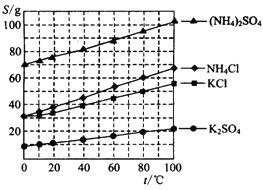
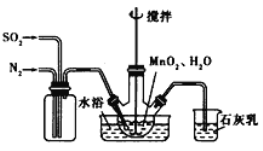
题目内容
【题目】请用化学方程式解释下列现象:
(1)可以服用小苏打治疗胃酸过多_____。
(2)铝制品不易锈蚀_____。
(3)铁桶不能盛放波尔多液_____。
(4)常用稀盐酸除铁锈_____。
(5)石灰浆粉刷墙壁,干燥后墙面变硬_____。
(6)氢气作为最理想的燃料_____。
【答案】NaHCO3+HCl=NaCl+H2O+CO2↑ 4Al+3O2=2Al2O3 Fe+CuSO4=FeSO4+Cu Fe2O3+6HCl═2FeCl3+3H2O Ca(OH)2+CO2═CaCO3↓+H2O 2H2+O2![]() 2H2O
2H2O
【解析】
首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可。
(1)小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑。故填:NaHCO3+HCl=NaCl+H2O+CO2↑
(2)铝制品不易锈蚀的原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式为:4Al+3O2=2Al2O3。故填:4Al+3O2=2Al2O3
(3)铁的活动性比铜强,铁和硫酸铜反应会生成硫酸亚铁和铜,铁桶不能盛放波尔多液,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu。故填:Fe+CuSO4=FeSO4+Cu
(4)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O。故填:Fe2O3+6HCl═2FeCl3+3H2O
(5)用石灰浆粉刷墙壁,干燥后墙面变硬,是因为氢氧化钙和空气中的二氧化碳反应生成了碳酸钙和水,反应的化学方程式是:Ca(OH)2+CO2═CaCO3↓+H2O。故填:Ca(OH)2+CO2═CaCO3↓+H2O
(6)氢气与氧气在点燃的条件下反应生成水,方程式为:2H2+O2![]() 2H2O;故填:2H2+O2
2H2O;故填:2H2+O2![]() 2H2O。
2H2O。

 阅读快车系列答案
阅读快车系列答案【题目】下列四个图象中,能正确反映对应变化关系的是( )
|
|
|
|
A.向一定质量的氢氧化钠溶液中加入稀硫酸至过量 | B.向一定质量的稀硫酸中加入锌片 | C.常温下,足量的镁、铁分别同时放入少量等质量、等质量分数的稀盐酸中 | D.向一定质量的二氧化锰中加入过氧化氢溶液 |
A. AB. BC. CD. D
【题目】小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。请计算:
第一次 | 第二次 | 第三次 | 第四次 | |
加入澄清石灰水的质量/g | 100 | 100 | 100 | 100 |
生成沉淀的质量/g | 0.4 | m | 1.0 | 1.0 |
(1)表中m的值为_____。
(2)Na2CO3溶液中溶质的质量分数_____(写出计算过程)。