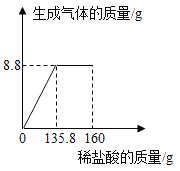
题目内容
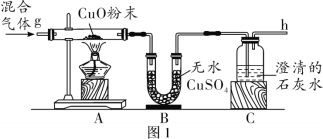
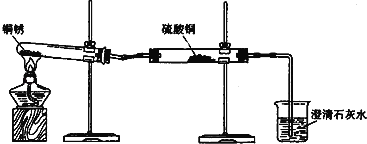
【题目】如图是一氧化碳还原氧化铁的装置,
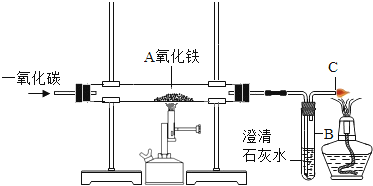
(1)该实验过程中A玻璃管内发生的现象是_____,反应的化学方程式_____。B试管中观察到的现象是_____,反应的化学方程式_____。
(2)酒精灯的作用是_____。
【答案】红棕色固体粉末变黑 3CO+Fe2O3![]() 2Fe+3CO2 澄清石灰水变浑浊 Ca(OH)2+CO2═CaCO3↓+H2O 将未参加反应的一氧化碳点燃,防止污染空气
2Fe+3CO2 澄清石灰水变浑浊 Ca(OH)2+CO2═CaCO3↓+H2O 将未参加反应的一氧化碳点燃,防止污染空气
【解析】
(1)A中,氧化铁在高温的条件下反应生成铁和二氧化碳,观察到红棕色固体慢慢变成黑色;二氧化碳与氢氧化该反应生成碳酸钙沉淀和水,所以观察到澄清的石灰水变浑浊;故填:红棕色固体粉末变黑;3CO+Fe2O3![]() 2Fe+3CO2;澄清石灰水变浑浊;Ca(OH)2+CO2═CaCO3↓+H2O;
2Fe+3CO2;澄清石灰水变浑浊;Ca(OH)2+CO2═CaCO3↓+H2O;
(2)最后的尾气中还含有一氧化碳,它有毒,不能直接排入大气中,可以把它燃烧,使其转化为二氧化碳再排入大气中;故填:将未参加反应的一氧化碳点燃,防止污染空气。

【题目】生活中常遇见铜制品生锈的情况.活动课上,同学们设计实验对铜锈进行了如下探究活动.
探究活动一:验证铜锈的组成
【査阅资料】①铜锈为绿色,其主要成分是Cu2(OH)2CO3.②白色的硫酸铜粉末遇水能变为蓝色.③碳不与稀硫酸反应.④氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液.
【进行实验1】同学们设计了如图所示装置并进行实验.
实验橾作 | 实验现象 | 实验结论 |
①按如图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有 ; 铜绣由 元素组成; 烧杯中发生反应的化学方程式为 . |
③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
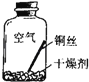
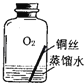
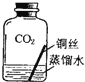
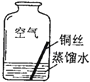
【进行实验2】同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显.
序号 | 实验内容 | 实验结论 | 实验反思 |
实验1 |
| 在干燥环境中,铜不易生锈 | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 . (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是 |
实验2 |
| ||
实验3 |
| ||
实验4 |
| 铜生锈的条件是
|