题目内容
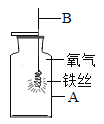
【题目】CH4、CO均有可燃性、还原性.按如图所示实验,反应的化学方程式为:![]()

加热一段时间后测得玻璃管中剩余固体14.4g。将该固体加入盛有152g足量稀硫酸的烧杯中充分反应后过滤,得到蓝色滤液和6.4g滤渣。计算
(1)实验中通入玻璃管中CH4出的质量_____0.4g(填“>”“<”或“=”)。
(2)实验结束后,试管中浓硫酸的质量分数变为_____(计算结果精确到0.1%,不考虑损失)。
(3)计算蓝色溶液中溶质的质量分数?_____(写出计算过程)
【答案】> 97.1% 10%
【解析】
(1)设参加反应的CH4质量为x,生成水的质量为y

x=0.4g,y=0.9g
由于反应前要先通甲烷排空气,反应后还要继续通入甲烷,实验过程中甲烷没有完全反应,所以实验中通入玻璃管中CH4的质量>0.4g,故填:>;
(2)根据溶质的质量分数公式,实验结束后,试管中浓硫酸的质量分数变为![]() ×100%=97.1%;故填:97.1%;
×100%=97.1%;故填:97.1%;
(3)设氧化铜与硫酸反应生成氯化铜质量为z
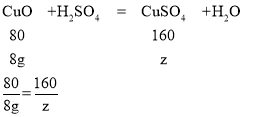
z=16g
蓝色溶液中溶质的质量分数为![]() ×100%=10%。
×100%=10%。
答:蓝色溶液中溶质的质量分数为10%。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】某化学兴趣小组用实验室常用药品(或溶液)对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究。
(知识卡片):氯化钠溶液显中性。氯化铜易溶于水。
(实验探究):
(1)方案Ⅰ:某同学先向试管中加入约2mLNaOH溶液,再滴入几滴酚酞溶液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色。
①实验结论_________。
②从微观的角度分析,该反应的实质是_________。
③在滴入稀盐酸的过程中,若观察到有少量气泡出现,请分析产生气泡的可能原因_______(用化学方程式表示)。
(2)方案Ⅱ:
实验步骤 | 实验现象 | 结论 |
取2mLNaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 | 若_______ | 稀盐酸过量 |
若没有明显现象 | NaOH溶液与稀盐酸恰好完全反应 |
(实验反思):
(3)另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是______。
(4)除以上方案外,下列哪些物质单独使用,也能证明“NaOH 溶液与稀盐酸是否恰好完全反应”_________ (填序号)。
A 铜片 B pH试纸 C 氧化铜 D 紫色石蕊试液