题目内容
【题目】通过海水晾晒可得粗盐。粗盐除含有NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如图所示。
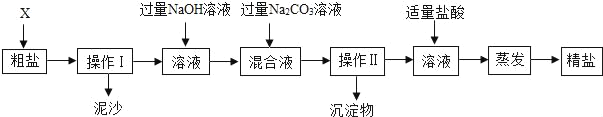
[提示:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;CaCl2+Na2CO3═CaCO3↓+2NaCl]
根据以上信息回答:
(1)在完成操作Ⅰ之前,必须加入的X物质是_____。
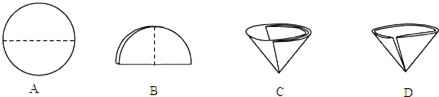
(2)操作Ⅰ和操作Ⅱ的名称是_____;操作中玻璃棒的作用是_____;该操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是_____(选填字母序号)。
(3)在蒸发操作中容易造成食盐固体飞溅,为尽量减少飞溅,可采取_____等措施(选填字母序号)。
A 玻璃棒不断搅拌 B 来回移动酒 C 精灯加热来回移 D 动蒸发皿加热
(4)在实验过程中加入过量的Na2CO3溶液,其实验目的是_____。
(5)判断加入的盐酸“适量”的方法是_____。
(6)实验所得精盐的质量大于粗盐中NaCl的质量,原因是_____。
【答案】水 过滤 引流 D ABC 除尽溶液中的钙离子 滴加盐酸至无气泡放出为止 在粗盐提纯的过程中有NaCl生成
【解析】
(1)根据粗盐的提纯需要将其配成溶液才能进行,
(2)分离固体与溶液的方法是过滤,
(3)根据蒸发的注意事项分析,
(4)氢氧化钠可以将水中的镁离子转化为沉淀而得到净水的目的,
(5)盐酸与碳酸钠反应是有气泡产生,
(6)在提纯过程中生成了氯化钠。
(1)海水晾晒得到的粗盐是固体,要进行提纯,需要先加水配成溶液
(2)分离固体与溶液的方法是过滤,I、II都是分离出沉淀的过程。操作中玻璃棒的作用是引流,滤纸对折再对折然后打开,不能有缝隙,故选D
(3)在蒸发操作中容易造成食盐固体飞溅,为尽量减少飞溅,可连续搅拌,还可采取玻璃棒不断搅拌或间歇加热或来回移动酒精灯的方法。
(4)加入过量的氢氧化钠,氢氧根离子可以和镁离子转化为氢氧化镁沉淀而将镁离子除去。
(5)此步是除掉多余的碳酸钠,而盐酸与碳酸钠反应是有气泡产生,从现象即可判断。
(6)在粗盐提纯的过程中,在提纯过程中生成了氯化钠。所以实验所得精盐的质量大于粗盐中NaCl的质量。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案