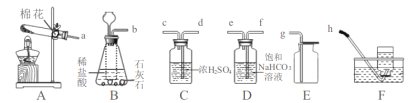
题目内容
【题目】现有氧化镁、氢氧化镁和硫酸镁的混合物10g,加入100g 9.8%的稀硫酸恰好完全反应,反应结束后蒸发,所得硫酸镁的质量可能是( )
A. 12gB. 17gC. 22gD. 15g
【答案】B
【解析】
可以根据质量守恒定律,依据硫酸根的质量求出生成硫酸镁的质量;再利用极值法确定所得硫酸镁的质量。
氧化镁、氢氧化镁与硫酸反应后都生成硫酸镁,反应前后硫酸根的质量不变,硫酸的质量为:100g×9.8%=9.8g,
硫酸根的质量为:9.8g×![]() ×100%=9.6g
×100%=9.6g
设生成硫酸镁的质量为X,则有:
X×![]() ×100%=9.6g,
×100%=9.6g,
X=12g。
当与稀硫酸反应的全部是氧化镁时,设氧化镁的质量为m,则有:
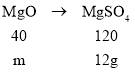
![]()
m=4g;
故混合物中硫酸镁的质量为:10g﹣4g=6g;所得硫酸镁的质量:12g+6g=18g;
当与稀硫酸反应的全部是氢氧化镁时,设氢氧化镁的质量为n,则有:
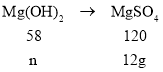
![]()
n=5.8g,
故混合物中硫酸镁的质量为:10g﹣5.8g=4.2g;所得硫酸镁的质量:4.2g+12g=16.2g;
因为混合物10g是氧化镁、氢氧化镁和硫酸镁的混合物,故所得硫酸镁的质量:16.2g~18g之间;
故选:B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据资料报道,世界上每年因锈蚀而报废的金属设备和材料相当于年产量的20%~40%,某实验小组对铁的锈蚀进行了如下探究.如图所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如下表.
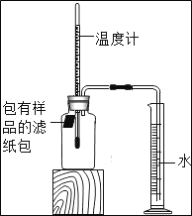
序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
① | 1g铁粉、0.2g碳和十滴水 | 100 | 72 | 约120 |
② | 1g铁粉、0.2g碳、十滴水和少量NaCl | 100 | 72 | 约70 |
③ | _____ | / | / | / |
(1)金属腐蚀的过程实际上就是金属元素化合价_____(填“升高”或“降低”)的过程.
(2)实验①和②说明NaCl可以_____(填“加快”或“减慢”)铁锈蚀的速率.
(3)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_____(填“放热”或“吸热”)过程.
(4)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是_____.
(5)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成_____.
(6)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是_____%(精确到0.1%).试分析该实验结果出现误差的原因:_____(写出任意一条即可).