题目内容
亚硝酸钠(NaNO2)是一种有咸味的工业用盐,对人体有毒害和致癌作用.该物质隔绝空气加热能分解放出有刺激性气味的气体,此气体可能是
- A.SO2
- B.NO2
- C.O2
- D.NH3
B
分析:根据质量守恒定律:化学反应前后元素的种类不变,可初步的判断生成物是什么.然后根据题中放出有刺激性气味的气体可排除O2.
解答:根据质量守恒定律:化学反应前后元素的种类不变,反应前亚硝酸钠(NaNO2)中存在钠、氮、氧三种元素,故反应后的生成物中不可能有SO2和NH3故A、D不正确.
氧气是无色无味的气体,故C不正确.
故选B.
点评:该题主要考查了质量守恒定律的应用,该题还要求学生要善于从题中挖掘出有用的解题信息(例如分解放出有刺激性气味的气体),以及要求学生要学会用排除法做选择题.
分析:根据质量守恒定律:化学反应前后元素的种类不变,可初步的判断生成物是什么.然后根据题中放出有刺激性气味的气体可排除O2.
解答:根据质量守恒定律:化学反应前后元素的种类不变,反应前亚硝酸钠(NaNO2)中存在钠、氮、氧三种元素,故反应后的生成物中不可能有SO2和NH3故A、D不正确.
氧气是无色无味的气体,故C不正确.
故选B.
点评:该题主要考查了质量守恒定律的应用,该题还要求学生要善于从题中挖掘出有用的解题信息(例如分解放出有刺激性气味的气体),以及要求学生要学会用排除法做选择题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
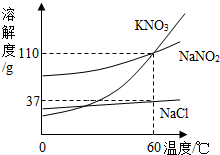 (2013?历下区二模)亚硝酸钠(NaNO2)常用作食品的发色剂和防腐剂,但食品中的亚硝酸钠含量超标会危害人体健康.亚硝酸钠具有咸味,外形和食盐很相似,亚硝酸钠的水溶液呈碱性.建筑行业常用亚硝酸钠作水泥添加剂,近年来,在建筑工地多次发生误将亚硝酸钠当作食盐食用导致中毒的事件.
(2013?历下区二模)亚硝酸钠(NaNO2)常用作食品的发色剂和防腐剂,但食品中的亚硝酸钠含量超标会危害人体健康.亚硝酸钠具有咸味,外形和食盐很相似,亚硝酸钠的水溶液呈碱性.建筑行业常用亚硝酸钠作水泥添加剂,近年来,在建筑工地多次发生误将亚硝酸钠当作食盐食用导致中毒的事件.