题目内容
【题目】工业上用如下工艺流程获得较纯净细白的碳酸钙用作食品添加剂,(石灰石中的杂质高温不分解、不溶于水且不与盐酸反应;氢氧化钙与盐酸反应没有气泡产生)试回答:
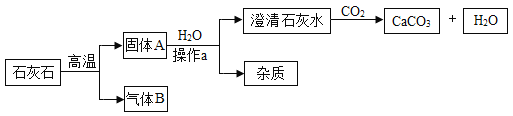
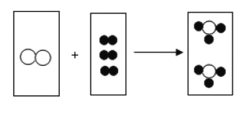
①石灰石高温分解的化学方程式是____________。
②为了节约成本,该工艺中可循环使用的物质是____________。
③有同学对流程中固体A的成分进行实验探究。
I.提出问题:石灰石中的碳酸钙是否完全分解了?
Ⅱ.进行猜想:①碳酸钙全部分解:②____________;③碳酸钙没有分解。
Ⅲ.设计实验方案、进行实验:
下表是对猜想①进行实验探究的过程:
实验步骤 | 实验现象 | 实验结论 |
取样,加适量水溶解,静置取少量上层清液于试管中,滴入酚酞试液;取少量下层固体于试管中,加入足量盐酸。 | 试液变为红色____________ | 碳酸钙全部分解 |
请你对猜想②进行探究,完成下表:
实验步骤 | 实验现象 | 实验结论 |
取样,加适量水溶解,静置,取少量上层清液于试管中,滴入酚酞试液;取少量下层固体于试管中,加入足量盐酸。 | ____________ | ____________ |
【答案】CaCO3![]() CaO+CO2↑ H2O、CO2 碳酸钙部分分解 没有气泡产生 试液变为红色,有气泡产生 碳酸钙部分分解
CaO+CO2↑ H2O、CO2 碳酸钙部分分解 没有气泡产生 试液变为红色,有气泡产生 碳酸钙部分分解
【解析】
①碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
②循环使用的物质在前面的反应中是反应物,到了后面的反应中又成了生成物,由工艺流程可知,固体加入试剂①变成石灰水,试剂①是水;石灰水加入试剂②得到碳酸钙和水,所以试剂②是二氧化碳,碳酸钙高温得到了氧化钙和二氧化碳,这里的二氧化碳可用于试剂②,所以可循环使用,试剂①是水,最后反应又生成了水,所以水也可以循环使用;
③Ⅱ、进行猜想:碳酸钙可能完全分解,可能部分分解,可能没有分解,所以猜想②是碳酸钙部分分解;
III、碳酸钙和盐酸反应会生成二氧化碳,氧化钙和水会生成氢氧化钙,氢氧化钙能使酚酞变红色,所以
对猜想①进行实验探究的过程:
实验步骤 | 实验现象 | 实验结论 |
取样,加适量水溶解,静置 | 试液变为红色;没有气泡产生 | 碳酸钙全部分解 |
对猜想②进行实验探究的过程:
实验步骤 | 实验现象 | 实验结论 |
取样,加适量水溶解,静置 | 试液变为红色;有气泡产生. | 碳酸钙部分分解 |
故答案为:①CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
②H2O、CO2;
③Ⅱ、进行猜想:碳酸钙部分分解;
III、对猜想①进行实验探究的过程:
实验步骤 | 实验现象 | 实验结论 |
没有气泡产生 |
对猜想②进行实验探究的过程:
实验步骤 | 实验现象 | 实验结论 |
试液变为红色,有气泡产生 | 碳酸钙部分分解 |