题目内容
【题目】水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)①自然界中的水都不是纯水,通过过滤可除去水中的_________ (填“不溶性”或“可溶性”)杂质。
② 热水瓶用久后,瓶胆内壁常附着一层水垢(主要成分是CaCO3和Mg(OH)2),可用稀盐酸来洗涤。写出盐酸与Mg(OH)2反应的化学方程式_____________________。
③ 某熟石灰久置于空气中,部分变质生成了碳酸钙,取l0g该熟石灰样品与足量的稀盐酸 充分反应后,生成l.lg二氧化碳,则l0g该样品中氢氧化钙的质量分数为多少?(请写出计算过程)_____
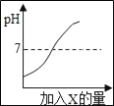
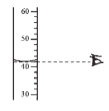
(2)如图是硝酸钾和氯化钠的溶解度曲线,回答下列问题。
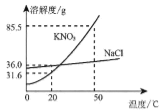
① 在50℃时,硝酸钾的溶解度是85.5g。这句话的含义是_______________。
② 20℃时,若从氯化钠和硝酸钾两种物质的饱和溶液中析出等质量的固体,须恒温蒸发掉较多水的是_________ (填“氯化钠”或“硝酸钾”)的饱和溶液。
③ 20℃时,在进行“粗盐中难溶性杂质的去除”实验过程中,如要溶解8g粗盐(粗盐中氯化钠含量约为80%)应选择_________ (填“l0mL”、“20mL”或“50mL”)规格的量筒,量取所需要的水最为合适。
④ 实验室用氯化钠固体配制50gl5%的氯化钠溶液,在溶解过程中,玻璃棒的作用是______。
【答案】不溶性 ![]() 75% 50℃时,100g水中最多可以溶解85.5g硝酸钾 氯化钠 20mL 搅拌加速溶解
75% 50℃时,100g水中最多可以溶解85.5g硝酸钾 氯化钠 20mL 搅拌加速溶解
【解析】
(1)①过滤是可溶性物质与不溶性物质分离的操作,所以通过过滤可除去自然界中水中不溶性杂质。
②盐酸与![]() 反应生成氯化镁和水,反应的化学方程式为
反应生成氯化镁和水,反应的化学方程式为![]() 。
。
③设l0g该样品中氢氧化钙的质量为x,则
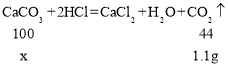
![]()
x=2.5g;
该样品中氢氧化钙的质量分数为![]() 。
。
(2)①在50℃时,硝酸钾的溶解度是85.5g,这句话的含义是50℃时,100g水中最多可以溶解85.5g硝酸钾。
②20℃时,氯化钠的溶解度大于硝酸钾溶解度,若从氯化钠和硝酸钾两种物质的饱和溶液中析出等质量的固体,须恒温蒸发掉较多水的是氯化钠的饱和溶液。
③20℃时,氯化钠溶解度为36.0g,8g粗盐含氯化钠的质量为8g×80%=6.4g,溶解6.4g氯化钠至少需要水的质量为![]() ,约合17.8 mL,在进行“粗盐中难溶性杂质的去除”实验过程中,如要溶解8g粗盐(粗盐中氯化钠含量约为80%)应选择20mL规格的量筒,量取所需要的水最为合适。
,约合17.8 mL,在进行“粗盐中难溶性杂质的去除”实验过程中,如要溶解8g粗盐(粗盐中氯化钠含量约为80%)应选择20mL规格的量筒,量取所需要的水最为合适。
④实验室用氯化钠固体配制50gl5%的氯化钠溶液,在溶解过程中,要用玻璃棒搅拌加速溶解。

【题目】化学规律建立在实验基础之上,质量守恒定律可以用许多化学实验加以验证。

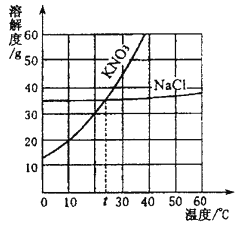
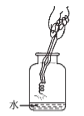
(1)小东同学按照课本上的实验进行验证(如图所示)。一段时间后,可以观察到铁钉表面出现_____,其反应的化学反应方程式为__,反应前后天平读数不变,但溶液颜色变化不明显。
(2)小东想既能验证质量守恒定律,又能更快地观察到溶液颜色的变化,提出了以下设想:
(提出设想)设想一:增大硫酸铜溶液的浓度
设想二:用更活泼的金属锌代替铁钉
(实验验证)小东将以上实验进行了如下改进:
实验内容 | 实验现象 | |
实验1 | 烧杯中换成饱和硫酸铜溶液 | ①几小时后溶液颜色几乎不变 ②天平读数不变 ③铁钉表面有变化 |
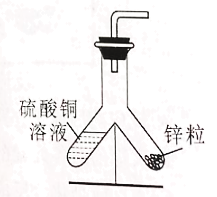
实验2 | 铁钉换成锌粒 | ①溶液颜色明显变浅 ②天平读数减小 ③锌粒表面有变化 |
(实验分析)(3)从以上现象分析,两个设想都不合适,其中按设想_____(填“一”或“二”)进行的实验能够验证质量守恒定律。
(4)实验1中溶液颜色几乎不变的原因可能是_____(填序号)。
A 铁与饱和硫酸铜溶液不反应
B 铁表面形成了一层氧化膜,阻止了反应的进一步进行
C 生成的铜快速沉积在铁表面,阻止了反应的进一步进行
D 水也参与了该反应,但饱和硫酸铜溶液中水太少
(5)实验2虽然很快观察到溶液颜色变化,但出现了反应后总质量减小的情况,老师提醒小东,硫酸铜溶液呈酸性,所以总质量减小的原因可能是____。
(6)小东通过反复实验和探究得出:向实验1的饱和硫酸铜溶液中加入等体积的水,将实验2中的烧杯换成如图所示装置,均能达到实验目的,但该装置中缺少一种物品,请你在装置图中画出____。