题目内容
【题目】金属的用途与性质密切相关。
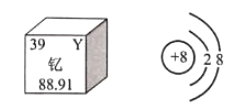
(1)图1所示赤铁矿的主要成分是_______(填化学式)。
(2)沿江铁路的建成,使常熟市民的出行更为方便。铁路建设需要大量的钢铁,在炼铁高炉中将赤铁矿还原为铁的主要化学方程式是___________。
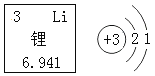
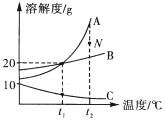
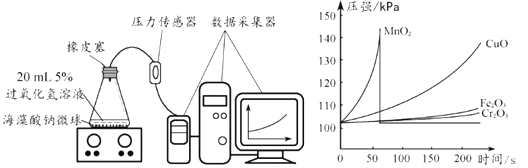
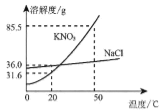
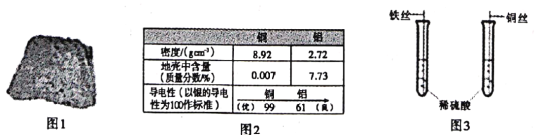
(3)家用电线常用铜制,但在高压远距离输电中,常用铝代替铜,请根据图2的信息分析,其原因是__________。
(4)在空气中,铝具有很好的抗腐蚀性,其原因用化学方程式表示为_______。
(5)新能源汽车越来越受到人们的青睐,华晨宝马530Le新能源汽车定位系统微电脑控制器应用了一种新型材料氮化铝( AlN)。工业上在氮气流中由氧化铝与焦炭在高温条件下制得氮化铝,并生成一种可燃性气体,该反应的化学方程式为____。
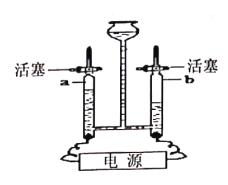
(6)为探究铁、铜的金属活动性,分别将铁丝、铜丝插入稀硫酸中(图3所示),说明铁比铜的金属活动性更强的实验现象是______,反应的化学方程式是____。
【答案】![]()
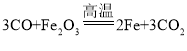 铝的密度比铜小,铝元素在地壳中的含量比铜元素高
铝的密度比铜小,铝元素在地壳中的含量比铜元素高 ![]()
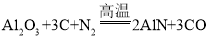 铁丝表面产生气泡,溶液变为浅绿色,铜丝表面无明显现象
铁丝表面产生气泡,溶液变为浅绿色,铜丝表面无明显现象 ![]()
【解析】
(1)赤铁矿的主要成分是三氧化二铁,化学式为![]() 。
。
(2)由题意在炼铁高炉中将赤铁矿还原为铁的主要反应为一氧化碳和三氧化二铁在高温条件下反应生成铁和二氧化碳,反应的化学方程式是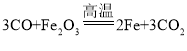 。
。
(3)家用电线常用铜制,但在高压远距离输电中,常用铝代替铜,根据图2的信息可知,其原因是铝的密度比铜小,铝元素在地壳中的含量比铜元素高。
(4)在空气中,铝具有很好的抗腐蚀性,是因为常温下铝与氧气反应生成三氧化二铝,在金属铝的表面形成了一层致密的氧化物薄膜,反应的化学方程式表示为![]() 。
。
(5)由题意工业上在氮气流中由氧化铝与焦炭在高温条件下制得氮化铝(AlN),并生成一种可燃性气体,根据质量守恒定律可知该气体由碳元素和氧元素组成,且具有可燃性,该气体为一氧化碳,故该反应的化学方程式为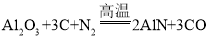 。
。
(6)如图3所示,为探究铁、铜的金属活动性,分别将铁丝、铜丝插入稀硫酸中,观察到铁丝表面产生气泡,溶液变为浅绿色,铜丝表面无明显现象,说明铁能与稀硫酸反应而铜不能与稀硫酸反应,则有铁比铜的金属活动性更强,铁与稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式是![]() 。
。

【题目】在宏观、微观和符号之间建立联系是化学学科的特点。高温下,甲和乙反应生成丙和丁,结合表中信息判断下列说法正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
|
化学式 | ? | C | CO | H2 | |
微观 示意图 |
|
|
| ? |
A. 甲的化学式为CO2 B. 保持丙化学性质的最小粒子为碳原子和氧原子
C. 反应物和生成物中都有化合物 D. 反应生成丙与丁的分子个数比为2:1
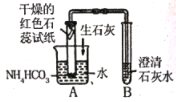
【题目】碳酸氢铵是一种常用的化肥,小组同学对碳酸氢铵进行相关的探究:
[查阅资料] (1)碳酸氢铵是一种白色粒状晶体,有氨味,易溶于水。
(2)氨气具有刺激性气味,极易溶于水,能使湿润的红色石蕊试纸变蓝。
[提出问题]碳酸氢铵有哪些化学性质?
[作出猜想]猜想一:碳酸氢铵能与酸反应;
猜想二:碳酸氢铵能与碱反应;
猜想三:碳酸氢铵易分解。
[设计与实验]
实验操作 | 实验现象 | 实验结论 | |
1 | ______ | 有气泡产生 | 猜想一正确 |
2 | 取少量碳酸氢铵样 品与熟石灰混合研磨 | ____ | 猜想二正确 |
3 |
| 红色石蕊试纸变蓝,澄清石灰水变浑浊 | 猜想三正确,B中发生反应的化学方程式 为____ |
[反思] (1)实验3中向水中加入氧化钙的目的是_______。
(2)有同学对实验2的结论提出质疑:碳酸氢铵易分解产生有刺激性气味的气体,研磨会使温度升高,能加快碳酸氢铵分解,所以实验2的结论不严谨。
[补充探究]有同学为了进一步验证猜想二,进行如下实验:
实验操作 | 实验现象 |
①将碳酸氢铵溶液加入到氢氧化钙溶液中 | 有白色沉淀生成,但没有气体逸出 |
②将碳酸氢铵溶液加入到氢氧化钠溶液中 | 有刺激性气味的气体生成 |
[分析]根据常见酸、碱、盐的溶解性分析,①实验中生成的白色沉淀是____,实验中没有气体逸出可能的原因是_______。
[实验结论]三个猜想均正确。
[拓展应用]保存或使用碳酸氢铵时,需注意_______(写出一点)。