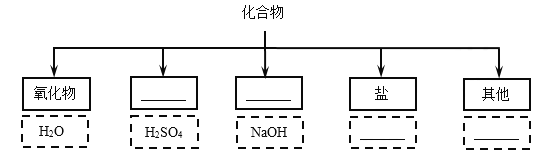
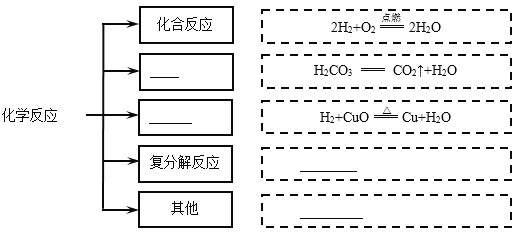
题目内容
【题目】下列物质中混有杂质(括号内为杂质),写出除去杂质所需的化学式。
(1)CO(CO2)_____(2)HCl(H2SO4)_____
【答案】NaOH BaCl2
【解析】
一氧化碳中有二氧化碳杂质,除去二氧化碳,将CO(CO2)通过氢氧化钠溶液,二氧化碳和氢氧化钠反应生成碳酸钠和水,一氧化碳不反应,则将二氧化碳除去了;盐酸中混有硫酸,除去硫酸加入适量氯化钡溶液,反应生成硫酸钡沉淀和盐酸,然后过滤即可。
(1)一氧化碳中有二氧化碳杂质,除去二氧化碳,将CO(CO2)通过氢氧化钠溶液,二氧化碳和氢氧化钠反应生成碳酸钠和水,一氧化碳不反应,则将二氧化碳除去了,反应方程式为![]() ,故填NaOH。
,故填NaOH。
(2)盐酸中混有硫酸,除去硫酸加入氯化钡溶液,反应生成硫酸钡沉淀和盐酸,然后过滤即可除去硫酸,化学方程式为![]() ,故填BaCl2。
,故填BaCl2。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目