��Ŀ����
����Ŀ��ij��ѧʵ��С��ͬѧ������Ͷ������ͭ��Һ�У��������ɺ�ɫ�������ʵ�ͬʱ�н϶�����ݷų������ɵ���ʲô�����أ�ͬѧ�Ǿ�������̽����̽��ǰ��ʦ��ʾ���÷�Ӧ���ɵ�����ֻ��һ�֡�
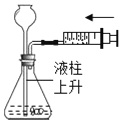
��������룩�ų������������SO2��O2��H2����������������______��
���������ϣ�SO2������ˮ����ѧ�����������̼������֮��������ʹ����ʯ��ˮ����ǣ�����CaSO3��
��������ƣ������������룬ʵ��С��ͬѧ�ֱ���������·�����
��1����ͬѧ��Ϊ��O2������鷽����______��
��2����ͬѧ��Ϊ��SO2�����轫�ų�������ͨ�����ʯ��ˮ�У�������ʯ��ˮ�Ƿ����ǡ�д��SO2��Ca(OH)2��Ӧ�Ļ�ѧ����ʽ______��
��3��ʵ��С��ͬѧ����ʦ��ָ���º���������������ʵ�鷽����ŨH2SO4���ڸ������壩���ų�����֤��������塣
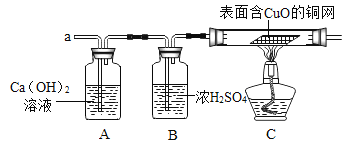
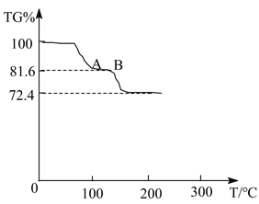
��ʵ��̽����ʵ�鿪ʼʱ���Ƚ��ռ����������aͨ��һ��ʱ����ٵ�ȼC���ƾ��ƣ�����������Ŀ����______��
ʵ������з���Aװ������Һ������ǣ�Cװ���б��溬CuO��ͭ���ɺ�ɫ��Ϊ�����ĺ�ɫ��
Cװ���з�����Ӧ�Ļ�ѧ����ʽ______��
���ۣ�����������ͭ��Һ��Ӧʱ��������������______��
��˼ά��չ��������ʵ������Ƴ�������ͭ��Һ�п��ܺ���______��
���𰸡������غ㶨�� �ô����ǵ�ľ�����飬�۲�ľ���Ƿ�ȼ Ca(OH)2+SO2=CaSO3��+H2O �ž�װ���ڵĿ�������ֹ����ʱ������ը H2+CuO![]() Cu+H2O H2 ����
Cu+H2O H2 ����
��������
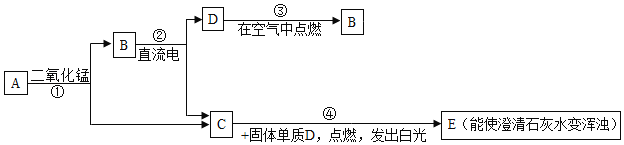
[�������]��������ͭ��Һ�к�������ͭ��������������Ԫ�أ����������غ㶨�ɣ�������Ԫ���γɵ�������SO2��O2��H2�����������غ㶨�ɡ�
[�������]��1�����������ķ������ô����ǵ�ľ�����飬�۲�ľ���Ƿ�ȼ�������ô����ǵ�ľ�����飬�۲�ľ���Ƿ�ȼ��
��2�������������������Ʒ�Ӧ����������Ƴ�����ˮ���ʷ�Ӧ�Ļ�ѧ����ʽдΪ��Ca(OH)2+SO2=CaSO3��+H2O��
[ʵ��̽��]��ͨ�������ȵ��������ž�װ���ڵĿ�������ֹ���ܴ��ڵ������������ϼ���ʱ������ը�������ž�װ���ڵĿ�������ֹ����ʱ������ը��
���溬CuO��ͭ���ɺ�ɫ��Ϊ�����ĺ�ɫ������������ͭ�ڸ��µ������·�Ӧ����ͭ��ˮ���ʷ�Ӧ�Ļ�ѧ����ʽдΪ��H2+CuO![]() Cu+H2O��
Cu+H2O��
�����Ͽ�֪������������ͭ��Һ��Ӧʱ������������������������H2��
[˼ά��չ]����������ͭ��Һ��Ӧʱ������������Ϊ������˵��ԭ��������ͭ��Һ�к������ᣬ�������ᡣ

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��1kg��ͬȼ��ȼ�ղ���CO2��SO2�����������ʾ��
ȼ�� | ȼ�ղ�������/g | |
CO2 | SO2 | |
���� | 2900 | 5.0 |
��Ȼ�� | 2500 | 0.1 |
ú | 2500 | 11.0 |
�����н�����ȼ����______��ʹ��______��ȼ��ʱ�����γ����ꡣ
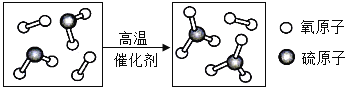
�������γɹ�����ijһ����Ӧ����ʾ��ͼ����ͼ��ʾ����÷�Ӧ�Ļ�ѧ����ʽΪ______��