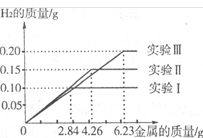
题目内容
(1)现有含杂质25 %的大理石20 g(杂质不与盐酸反应)恰好与150 g稀盐酸完全反应。求:①产生二氧化碳多少克? ②稀盐酸中溶质的质量分数为多少?
(2)质量相同的Na2CO3和CaCO3分别与足量稀盐酸反应,产生二氧化碳的质量比为
。
(2)质量相同的Na2CO3和CaCO3分别与足量稀盐酸反应,产生二氧化碳的质量比为
。
(1)6.6g 7.3% (2)(2)50:53
试题分析:(1)先根据大理石的质量和所含杂质的质量分数求出参加反应的碳酸钙的质量,根据题意,书写出反应的化学方程式,再利用碳酸钙与二氧化碳,以及碳酸钙与盐酸的质量比,分别求出生成的二氧化碳的质量和稀盐酸中溶质的质量。
20g含杂质25 %的大理石中含碳酸钙的质量为20g×(1-25%)=15g;
设产生二氧化碳的质量为x,盐酸中HCl的质量为y
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 73 44
15g y x
① 100 :44 =" 15g" :x
解得x =" 6.6g"
② 100 :73 =" 15g" :y
解得y =" 10.95g"
则稀盐酸中溶质的质量分数=
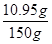 ×100%=7.3%
×100%=7.3% 答:反应产生的二氧化碳的质量为6.6g;稀盐酸中溶质的质量分数为7.3%。
(2)根据题目中的反应物、生成物和反应条件,依据化学方程式的书写方法,可以写出Na2CO3和CaCO3分别与足量的盐酸反应的化学方程式;根据化学方程式分别找出Na2CO3和CaCO3与二氧化碳气体的质量比,再由Na2CO3和CaCO3的质量,可分别表示出生成的二氧化碳气体质量,并求出它们的比值即可。
设Na2CO3和CaCO3的质量都为a,而Na2CO3和CaCO3分别与盐酸反应生成的二氧化碳的质量分别为x、y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
a x
106:44=a:x
解得x=
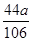
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
a y
100:44=a:y
解得y=
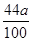
则x:y=
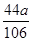 :
: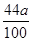 =50:53
=50:53点评:本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键。

练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目