题目内容
(3分)在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:取废液10kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液。所得溶液pH与加入的碳酸钠溶液的质量关系如右图所示(已知:Na2CO3+CaCl2=CaCO3↓+2NaCl):
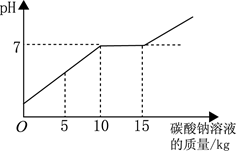
(1)通过右图可知,当碳酸钠溶液质量加到 kg时,废液恰好处理完(盐酸与氯化钙的混合溶液完全转化成氯化钠溶液)。
(2)计算废液中氯化钙的质量分数。

(1)通过右图可知,当碳酸钠溶液质量加到 kg时,废液恰好处理完(盐酸与氯化钙的混合溶液完全转化成氯化钠溶液)。
(2)计算废液中氯化钙的质量分数。
(1)15kg
(2)11.1 %
(2)11.1 %
试题分析:(1)通过右图可知,当碳酸钠溶液质量加到15kg时,溶液PH开始大于7,说明此时废液恰好处理完,碳酸钠溶液开始过量。
(2) 解:由图像可知与溶液中氯化钙反应的碳酸钠溶液的质量为:15kg-10kg=5kg
设废液中氯化钙的质量为x
Na2CO3 + CaCl2="==" CaCO3↓ + 2NaCl
106 111
5kg×21.2% x
 x ="1.11kg"
x ="1.11kg" 原废液中氯化钙的质量分数为
 ×100% =" 11.1" %
×100% =" 11.1" %答:废液中氯化钙的溶质质量分数为11.1 %
点评:注意题中图像的含义,当碳酸钠溶液质量加到10kg以前,都是碳酸钠与盐酸反应,加到10kg---15kg时,是碳酸钠与氯化钙反应,超过15kg后,碳酸钠溶液过量。根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

