题目内容
金属是现代生活、工业生产以及科学研究中应用极为普遍的一类材料.
(1)青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具.
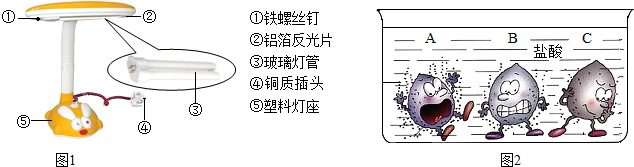
①如图1所示的台灯,序号标示的物质中属于金属材料的有 (填序号);小明发现台灯的铁螺丝钉表面已经锈蚀,原因是铁与空气中的氧气及 等发生了化学反应.
②小红发现铝箔反光片呈银白色,无锈迹,原因是铝表面有一层致密的氧化膜,生成该氧化膜的化学方程式为 .
(2)如图2是三种常见金属在稀盐酸反应的现象示意图.
①A、B、C三种金属的活动性由强到弱的顺序是 .
②若金属C是世界年产量最多应用最广的金属,C元素在地壳中含量位居第四.其与稀盐酸发生反应后的溶液中,溶质一定有 (写化学式).
③若A、B分别为镁和锌,等质量的A、B在足量的盐酸中反应生成氢气质量较大的是 .(选填A或B)
(3)金属的开发和利用是人类文明和社会进步的标志.
①我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热至800℃左右,即可得到与黄金外观相似的“药金”.“药金”是 (填“纯金属”或“合金”);
②钛(元素符号Ti)因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”.由钒钛磁铁矿提取金属钛的主要工艺过程如下:
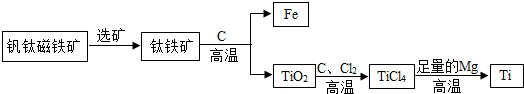
Ⅰ.TiCl4在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为: .
Ⅱ.上述生产过程中得到的金属钛中混有少量金属杂质,可加入 除去.
(1)青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具.
①如图1所示的台灯,序号标示的物质中属于金属材料的有
②小红发现铝箔反光片呈银白色,无锈迹,原因是铝表面有一层致密的氧化膜,生成该氧化膜的化学方程式为

(2)如图2是三种常见金属在稀盐酸反应的现象示意图.
①A、B、C三种金属的活动性由强到弱的顺序是
②若金属C是世界年产量最多应用最广的金属,C元素在地壳中含量位居第四.其与稀盐酸发生反应后的溶液中,溶质一定有
③若A、B分别为镁和锌,等质量的A、B在足量的盐酸中反应生成氢气质量较大的是
(3)金属的开发和利用是人类文明和社会进步的标志.
①我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热至800℃左右,即可得到与黄金外观相似的“药金”.“药金”是
②钛(元素符号Ti)因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”.由钒钛磁铁矿提取金属钛的主要工艺过程如下:

Ⅰ.TiCl4在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:
Ⅱ.上述生产过程中得到的金属钛中混有少量金属杂质,可加入
分析:(1)根据金属材料包括金属单质及合金,从中找出金属材料,铁生锈的条件是与氧气和水同时接触以及铝和氧气反应生成氧化铝进行解答;
(2)根据金属活动强的金属与酸反应放出氢气的速率快进行解答;
(3)根据“药金”中含有多种金属元素以及非金属元素,所以属于合金;TiCl4在高温下与足量Mg反应置换生成金属Ti和氯化镁;金属钛中混有少量金属杂质镁,钛常温下不和酸反应,而镁和酸反应进行解答.
(2)根据金属活动强的金属与酸反应放出氢气的速率快进行解答;
(3)根据“药金”中含有多种金属元素以及非金属元素,所以属于合金;TiCl4在高温下与足量Mg反应置换生成金属Ti和氯化镁;金属钛中混有少量金属杂质镁,钛常温下不和酸反应,而镁和酸反应进行解答.
解答:解:(1)①金属单质及合金都属于金属材料,①铁螺丝钉、②铝箔反光片、④铜质插头都属于金属材料;玻璃属于硅酸盐材料,塑料灯座属于有机高分子合成材料;台灯的铁螺丝钉表面已经锈蚀,原因是铁与空气中的氧气及水等发生了化学反应;
②铝箔反光片呈银白色,无锈迹,原因是铝表面有一层致密的氧化膜,生成该氧化膜的化学方程式为4Al+3O2=2Al2O3;
(2)金属活动强的金属与酸反应放出氢气的速率快,由图可知,A与盐酸反应放出氢气的速率最快,B次之,C最慢,所以A、B、C三种金属的活动性由强到弱的顺序是A、B、C;
②若金属C是世界年产量最多应用最广的金属,C元素在地壳中含量位居第四,则C是铁,铁和盐酸反应生成氯化亚铁和氢气,所以溶质一定有氯化亚铁;
③若A、B分别为镁和锌,等质量的A、B在足量的盐酸中反应生成氢气质量较大的是镁;
(3)①“药金”中含有多种金属元素以及非金属元素,所以属于合金;
②Ⅰ:TiCl4在高温下与足量Mg反应置换生成金属Ti和氯化镁,该反应的化学方程式为2Mg+TiCl4
2MgCl2+Ti;
Ⅱ金属钛中混有少量金属杂质镁,钛常温下不和酸反应,而镁和酸反应,所以金属钛中混有少量金属杂质,可加入稀盐酸除去.
故答案为:(1)①:①②④;水;②4Al+3O2=2Al2O3;
(2)①A、B、C;②FeCl2;③A;
(3)①合金;②2Mg+TiCl4
2MgCl2+Ti;稀盐酸.
②铝箔反光片呈银白色,无锈迹,原因是铝表面有一层致密的氧化膜,生成该氧化膜的化学方程式为4Al+3O2=2Al2O3;
(2)金属活动强的金属与酸反应放出氢气的速率快,由图可知,A与盐酸反应放出氢气的速率最快,B次之,C最慢,所以A、B、C三种金属的活动性由强到弱的顺序是A、B、C;
②若金属C是世界年产量最多应用最广的金属,C元素在地壳中含量位居第四,则C是铁,铁和盐酸反应生成氯化亚铁和氢气,所以溶质一定有氯化亚铁;
③若A、B分别为镁和锌,等质量的A、B在足量的盐酸中反应生成氢气质量较大的是镁;
(3)①“药金”中含有多种金属元素以及非金属元素,所以属于合金;
②Ⅰ:TiCl4在高温下与足量Mg反应置换生成金属Ti和氯化镁,该反应的化学方程式为2Mg+TiCl4
| ||
Ⅱ金属钛中混有少量金属杂质镁,钛常温下不和酸反应,而镁和酸反应,所以金属钛中混有少量金属杂质,可加入稀盐酸除去.
故答案为:(1)①:①②④;水;②4Al+3O2=2Al2O3;
(2)①A、B、C;②FeCl2;③A;
(3)①合金;②2Mg+TiCl4
| ||
点评:解答本题要掌握金属的性质和物质材料的分类方法,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 金属是现代生活和工业生产中应用极为普遍的一类材料.
金属是现代生活和工业生产中应用极为普遍的一类材料.(1)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快.Al、Cu、Fe三种金属在稀盐酸里的反应现象如右图所示.
①右图中Y所代表的金属是
②Al、Cu、Fe三种金属的活动性由强到弱的顺序为
③铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是
(2)金属的开发和利用是人类文明和社会进步的标志.
①我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热至800℃左右,即可得到与黄金外观相似的“药金”.
I.用上述方法不能制得真正的黄金(Au)是因为
II.“药金”是
②钛因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”.由钒钛磁铁矿提取金属钛的主要工艺过程如下:
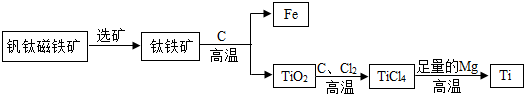
在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:
上述生产过程中得到的金属钛中混有少量金属杂质,可加入
(3)已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.
资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
①请完成证明金属粉末中存在Fe和Cu的实验设计:
| 实验操作 | 实验现象 | 结论 |
| Ⅰ取少量的金属粉末于试管中,加入足量的 |
仅除去铝 | |
| Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸. | 证明含有铁 | |
| Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
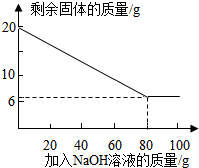 ②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:
②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 16.5 | n | 9.5 | … |
Ⅱ.该金属粉末中Al的质量分数为
Ⅲ.列式计算:所用氢氧化钠溶液的溶质质量分数为多少?
金属是现代生活和工业生产中应用极为普遍的一类材料.
已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.
(查阅资料)Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
①请完成证明金属粉末中存在Fe和Cu的实验设计:
②为探究该金属粉末中Al的质量分数,取20g该金属粉末,把100g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:
I.分析以上数据可知上表中n的值为 ;
II.该金属粉末中Al的质量分数为 %;
III.列式计算:所用氢氧化钠溶液的溶质质量分数为多少?
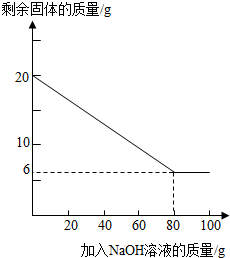
已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.
(查阅资料)Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
①请完成证明金属粉末中存在Fe和Cu的实验设计:
| 实验操作 | 实验现象 | 结论 |
| Ⅰ取少量的金属粉末于试管中,加入足量的________________(填试剂名称). | _____________. | 仅除去铝 |
| Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸. | _____________. | 证明含有铁 |
| Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 16.5 | n | 9.5 | … |
II.该金属粉末中Al的质量分数为
III.列式计算:所用氢氧化钠溶液的溶质质量分数为多少?



