题目内容
【题目】⑴请你判断下列化学式中的“2”分别表示下述哪种含义?
①表示离子的电荷数 ②表示微粒的数目 ③表示元素的化合价(填序号)2H______ ![]() ________________ Zn2+________
________________ Zn2+________
⑵判断下列物质的类别,并用相应的序号填空:
①单质 ②氧化物 ③酸 ④碱 ⑤盐
物质化学式 | P2O5 | Ca(OH)2 | H2CO3 |
物质类别 | _______ | _______ | _______ |
【答案】 ② ③ ① ② ④ ③
【解析】(1).元素符号的前边加数字表示原子的个数,2H表示两个氢原子;(2).元素化合价的书写:在元素符号的正上方标化合价的数值,正负号在左,数字在右。![]() 表示硫酸钡中钡元素显+2价;(3).离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写; Zn2+表示一个锌离子带两个单位正电荷;(4).P2O5是由两种元素组成的纯净物,且其中一种是氧,属于氧化物;(5).Ca(OH)2由金属和氢氧根组成,属于碱;(6).H2CO3由氢和酸根组成,属于酸。
表示硫酸钡中钡元素显+2价;(3).离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写; Zn2+表示一个锌离子带两个单位正电荷;(4).P2O5是由两种元素组成的纯净物,且其中一种是氧,属于氧化物;(5).Ca(OH)2由金属和氢氧根组成,属于碱;(6).H2CO3由氢和酸根组成,属于酸。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】通过联想提出问题是探究的源泉,某合作学习小组开展了如下探究,请你协助他们完成:
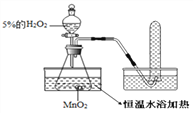
【提出问题】温度越高,分子运动越快;温度越高,化学反应也越快吗?
【实验探究】为了探究温度对H2O2分解反应速率的影响,某实验小组使用如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分数据如表所示:
实验1 | 实验2 | |
MnO2的质量/g | 0.5 | 0.5 |
5%的H2O2的体积 /mL | 40 | X |
恒温水浴加热/℃ | 40 | 80 |
收集一试管氧气所需要时间/ 秒 | 36 | 23 |
(1)实验2中X=____;
(2)在两次实验中,记录不同温度下收集同体积的氧气所需要时间的实验设计目的是______;还可以_______________________ 达到相同的目的,
【实验结论】通过两次实验的实验记录,你可以得出的实验结论是:_________________ ;
【实验拓展】请根据所学再举出一例与温度有关的实验结论:温度越高,_________。
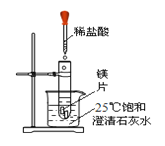
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中然烧的实验(如图1)。
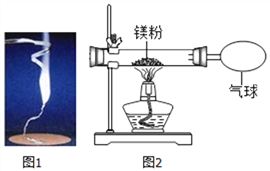
同学们观察到镁条在空气中剧烈燃烧,发出耀眼的白光,因此镁在军事上作_________;
同时同学们还观察到产生的大量白烟弥漫到空气中,最后一些白色固体掉落在仪器A上。
(1)上述仪器A名称是____________。
(2)同学们通过称量发现:在仪器A上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:____________。
(3)小红按下图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁( Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
实验操作 | 实验现象及结论 |
_______________________ | ________________ |
【反思与交流】
①写出镁条燃烧生成氮化镁的化学方程式为____________________;
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_________________;
③同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识:___________