题目内容
【题目】硫酸锌可作为食品添加剂。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的FeO、CuO。工艺流程图如下:(假设每一步骤反应均完全)
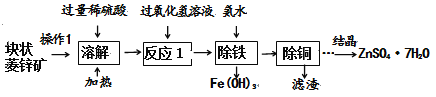
⑴为提高矿石的溶解速度,操作1是___________ 。
⑵菱锌矿溶解后所得的溶液中金属阳离子有_____________种。
⑶反应1中H2O2转化为H2O,同时有Fe2(SO4)3生成,写出反应1中生成Fe2(SO4)3的化学方程式___________________________。
⑷结晶之前,溶液中除了硫酸锌,还一定存在的溶质是_________________。
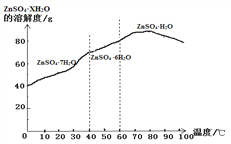
⑸硫酸锌晶体的溶解度曲线如下图所示,若要获得ZnSO4·7H2O晶体,应控制结晶时的温度范围为____________________。
⑹流程中还可能得到一种紫罗兰色晶体(NH4)xFey(SO4)z·7H2O。已知该化合物中氮、铁元素质量比为1:4,则x:y :z=________
【答案】 粉碎 3 2FeSO4+H2O2+H2SO4= Fe2(SO4)3+2H2O (NH4)2SO4 0℃到40℃ 1:1:2
【解析】⑴增大物质的表面积可增大溶解速率,为提高矿石的溶解速度,操作1是粉碎;⑵菱锌矿溶解后所得的溶液中金属阳离子有锌离子、亚铁离子、铜离子三种;⑶反应1中H2O2转化为H2O,同时有Fe2(SO4)3生成,则反应1中生成Fe2(SO4)3的化学方程式为:2FeSO4+H2O2+H2SO4= Fe2(SO4)3+2H2O;⑷氨水和硫酸亚铁反应生成硫酸铵和氢氧化亚铁,结晶之前,溶液中除了硫酸锌,还一定存在的溶质是硫酸铵;⑸由硫酸锌晶体的溶解度曲线可知,若要获得ZnSO4·7H2O晶体,应控制结晶时的温度范围为0℃到40℃,温度生高,结晶水减少;⑹紫罗兰色晶体(NH4)xFey(SO4)z·7H2O中氮、铁元素质量比为1:4,则14z:56y=1:4,x:y=1:1, 化合物中元素的化合价代数和为零,(+1)×2+(+3)×1+(-2)×2=0,所以z=2,即x:y :z= 1:1:2。

【题目】⑴请你判断下列化学式中的“2”分别表示下述哪种含义?
①表示离子的电荷数 ②表示微粒的数目 ③表示元素的化合价(填序号)2H______ ![]() ________________ Zn2+________
________________ Zn2+________
⑵判断下列物质的类别,并用相应的序号填空:
①单质 ②氧化物 ③酸 ④碱 ⑤盐
物质化学式 | P2O5 | Ca(OH)2 | H2CO3 |
物质类别 | _______ | _______ | _______ |