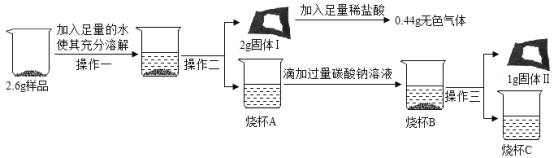
题目内容
【题目】某兴趣小组用图1 装置进行实验时发现,烧杯中饱和石灰水先变浑浊,后逐渐澄清。
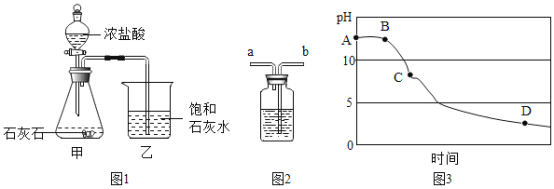
(1)写出甲装置中发生反应的化学方程式_______。
(2)为探究“饱和石灰水浑浊后变澄清的原因”,该小组同学开展了如下活动:
(查阅文献)碳酸钙(碳酸钠等)与二氧化碳、水反应生成可溶于的碳酸氢钙(碳酸氢钠等)。
(提出假设)假设 1:挥发出的HCl使浑浊变澄清;假设2:______。
(设计实验)同学们设计实验证明假设1正确。为证明假设2,他们如下设计:为除去CO2中的HCl,小华在图1中甲、乙装置之间增加图2装置,装置的连接顺序是甲→____→____→乙(填字母序号);其中存放的试剂合理的是_______(填选项序号)。
A 浓硫酸 B 饱和Na2CO3溶液 C 饱和NaHCO3溶液
(实验现象)饱和石灰水浑浊后,继续通入足量 CO2 ,沉淀部分溶解但最终并未完全澄清。
(得出结论)由以上探究可得出结论是___________。
(3)该兴趣小组在老师指导下,用 pH 传感器测得图 1烧杯中溶液的 pH 随通入时间的变化曲线如图3。D点所得溶液的成分除 H2O外还有_________。
【答案】![]() 产生的二氧化碳使石灰水变澄清 b a C 假设1成立 盐酸(HCl)和氯化钙(CaCl2)
产生的二氧化碳使石灰水变澄清 b a C 假设1成立 盐酸(HCl)和氯化钙(CaCl2)
【解析】
(1)甲装置中石灰石的主要成分碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是:![]() ;
;
(2)提出假设:
由文献资料,碳酸钙(碳酸钠等)与二氧化碳、水反应生成可溶于水的碳酸氢钙,则可提出假设产生的二氧化碳使石灰水变澄清;
设计实验:
图中装置用作洗气瓶时,进气管与出气管的方向是“长进短出”,小华在图1中甲、乙装置之间增加图2装置,装置的连接顺序是甲→b→a→乙;其中盛放的试剂合理的是碳酸氢钠溶液,碳酸氢钠能与氯化氢气体反应生成氯化钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则。
得出结论:
根据饱和石灰水浑浊后,继续通入足量CO2,沉淀部分溶解但最终并未完全澄清可得出的结论是挥发出来的氯化氢使饱和石灰水产生的浑浊最终变澄清,假设1成立;
(3)D点溶液的pH小于5,所得澄清溶液的成分除H2O外,还有氯化氢气体溶于水生成的盐酸(HCl),氯化氢与氢氧化钙反应生成的氯化钙(CaCl2)。

【题目】化学兴趣小组对实验室药品柜中的一瓶盐酸的性质和质量分数进行探究,请你参与:
知识回顾:在打开浓盐酸时常会看到瓶口有_____的现象,浓盐酸具有挥发性,导致这瓶盐酸溶液的质量分数变_____(填“大”、“小”)。
(实验探究Ⅰ)探究这瓶盐酸的化学性质
(1)请从下列试剂中选择试剂进行检验盐酸的化学性质,填写实验报告:
供选择试剂:紫色石蕊试液、酚酞试液、锌粒、铜片、氧化铜、氢氧化钠溶液、硫酸铜溶液
实验步骤 | 预计实验现象 |
取少量溶液于试管中,滴加_____ | 溶液变红色 |
另取少量溶液于试管中加入_____ | 有气泡产生 |
(实验探究Ⅱ)测定这瓶盐酸溶液中溶质的质量分数
(查阅资料)HCl+AgNO3═AgCl↓+2HNO3
(设计实验)小组同学设计了如下两套方案,请协助他们完成实验方案的设计。
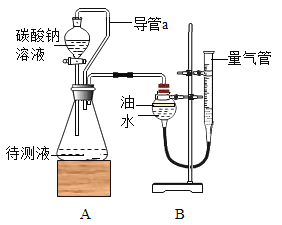
方案Ⅰ往盐酸中加入碳酸钠溶液反应产生气体,通过产生气体的量进行计算。取20mL的盐酸于锥形瓶中,加入足量的碳酸钠溶液并用如图所示装置进行实验:(假设该实验温度下,盐酸的密度均为1g/mL,二氧化碳的密度为2g/L)
(2)实验装置A中发生反应的化学方程式为_____。
(3)实验过程中,当观察到_____,说明加入的碳酸钠已经足量了。
(4)实验前量气管中水的体积为2.0mL,实验结束后量气管中水的体积为222.0mL,则生成二氧化碳的体积是_____mL。
(5)同学经过交流讨论后认为还必须考虑装置A和装置B内原有的气体.你认为装置A和装置B内原有的气体对实验的结果_____(填“有”或“没有”)影响。方案Ⅱ盐酸中加入硝酸银溶液反应产生沉淀,通过产生沉淀的量进行计算。于是同学们另取一定量的盐酸,按如下流程进行探究:
![]()
(6)产生的白色沉淀物质是_____。