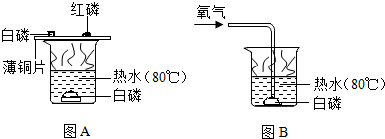
题目内容
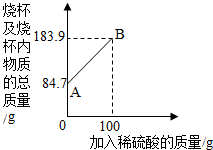 小华为测定某铁碳含金样品的成分,进行了如下实验:取一定质量的样品粉末于质量为61.7克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入100g稀硫酸时反应恰好完全,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图.
小华为测定某铁碳含金样品的成分,进行了如下实验:取一定质量的样品粉末于质量为61.7克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入100g稀硫酸时反应恰好完全,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图.试通过计算完成下列问题:(不能整除时,结果保留一位小数)
(1)该实验取用的样品质量为:
(2)请通过计算确定该样品属于生铁还是钢.(生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%)请写出计算过程;
(3)小华不慎在反应结束后,向烧杯中多了20g稀硫酸,请你帮小华在图中补绘出此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图.
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)实验开始时烧杯及烧杯内物质样品的总质量为84.7g,因此,总质量减去烧杯的质量即为取用的样品质量;
(2)利用质量守恒定律可计算出铁与硫酸恰好完全反应时放出氢气的质量,由反应产生氢气的质量,根据反应的化学方程式,计算参加反应的铁的质量,进而求样品中碳的质量分数;
(3)多加的硫酸没发生反应而溶液质量直接增加,而此前溶液增加量为所加稀硫酸质量与放出氢气质量的差,因此,补绘的线段的终点高于原线段的沿长线.
(2)利用质量守恒定律可计算出铁与硫酸恰好完全反应时放出氢气的质量,由反应产生氢气的质量,根据反应的化学方程式,计算参加反应的铁的质量,进而求样品中碳的质量分数;
(3)多加的硫酸没发生反应而溶液质量直接增加,而此前溶液增加量为所加稀硫酸质量与放出氢气质量的差,因此,补绘的线段的终点高于原线段的沿长线.
解答:解:(1)该实验取用的样品质量=84.7g-61.7g=23g
故答案为:23g;
(2)根据质量守恒定律,恰好完全反应时放出氢气的质量=100g+84.7g-183.9g=0.8g,
设参加反应铁的质量为x,生成硫酸亚铁的质量为y,则
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.8g
=
x=22.4g,
样品中碳的质量分数=
×100%≈2.6%
答:样品中碳的质量分数为2.6%,故样品属于生铁.
(3)由于多加入20g稀硫酸时反应已经结束,不会有气体产生,溶液增加幅度大于恰好完全反应前的溶液增加幅度,所以,补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的上方,即斜率比AB段斜率大;
故答案为: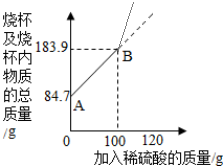 .
.
故答案为:23g;
(2)根据质量守恒定律,恰好完全反应时放出氢气的质量=100g+84.7g-183.9g=0.8g,
设参加反应铁的质量为x,生成硫酸亚铁的质量为y,则
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.8g
| 56 |
| x |
| 2 |
| 0.8g |
x=22.4g,
样品中碳的质量分数=
| 23g-22.4g |
| 23g |
答:样品中碳的质量分数为2.6%,故样品属于生铁.
(3)由于多加入20g稀硫酸时反应已经结束,不会有气体产生,溶液增加幅度大于恰好完全反应前的溶液增加幅度,所以,补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的上方,即斜率比AB段斜率大;
故答案为:
 .
.点评:根据质量守恒定律,恰好完全反应时放出氢气的质量=恰好完全反应时所加稀硫酸的质量+实验开始时烧杯及烧杯内样品的质量-恰好完全反应时烧杯与烧杯内物质的质量.

练习册系列答案
相关题目
在化学反应2Al+Fe2O3
2Fe+Al2O3中,氧化剂是( )
| ||
| A、Al2O3 |
| B、Fe2O3 |
| C、Fe |
| D、Al |
下列关于氧气的用途叙述不正确的是( )
| A、能助燃 |
| B、可以做火箭的燃料 |
| C、焊接或切割金属 |
| D、供病人呼吸 |