题目内容
【题目】某同学发现一瓶没有塞上瓶塞的过氧化氢溶液,对该溶液中是否有过氧化氢的剩余,与同学们一起进行如下探究实验。
(猜想与假设)
猜想⑴:该溶液中有过氧化氢的剩余。猜想⑵:该溶液中没有过氧化氢的剩余。
(方案讨论)为了验证猜想,甲、乙、丙三同学分别提出如下方案
甲:取适量试剂于试管中,伸入带火星的木条,若带火星的木条复燃,则猜想(1)成立,若带火星的木条不复燃,猜想(2)成立.
同学们认为此方案不行,原因是____________________。
乙:取少量二氧化锰于试管中,加入与甲等量的试剂,若有气泡产生,则猜想(1)成立,若无气泡产生则猜想(2)成立,理由是______(写化学反应的文字表达式)
丙:
操作 | 现象 | 结论 |
取与甲等量试剂于试管中,加热,伸入带火星的木条 | __________________ | 猜想(1)成立 |
(反思与交流)1、敞口放置的试剂容易变质,所以要______保存。
2、二氧化锰在过氧化氢的分解过程中起________作用。除此之外能改变化学反应速率的方法还可以______________
【答案】常温下过氧化氢分解缓慢,产生的氧气少,不能使带火星的木条复燃。过氧化氢![]() 水+氧气有气泡产,带火星的木条复燃密封催化加热
水+氧气有气泡产,带火星的木条复燃密封催化加热
【解析】
(1)常温下过氧化氢在没有催化剂的条件下分解缓慢,产生的氧气少,不能使带火星的木条复燃,故不能说明不剩余过氧化氢;
(2)过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气,反应的文字表达式为:过氧化氢![]() 水+氧气;
水+氧气;
(3)猜想(1)成立,说明有氧气生成,故可以看到有气泡冒出、带火星的木条复燃;
(4)试剂敞口放置会变质,要密封保存;该反应中,加入二氧化锰后加快了反应的速率,而二氧化锰的质量和化学性质都没有改变,故二氧化锰是该反应的催化剂,起催化作用;由实验可知,加热也可能改变反应的速率;

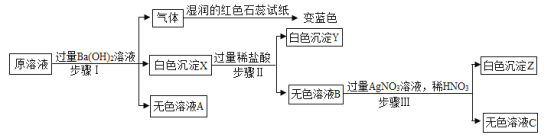
【题目】氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。
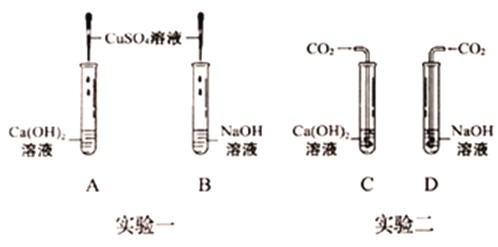
(1)实验一中,B试管中发生反应的化学方程式为_____。
A、B两支试管中共同的实验现象是_____。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是_____(填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
(提出猜想)猜想1:溶质是NaOH。
猜想2:溶质是NaOH和Na2CO3
猜想3:溶质是Na2CO3
实验操作 | 实验现象 | 实验结论 |
①取D中少量溶液于试管中加入过量稀盐酸 | _____ | 猜想1不成立 |
②取D中少量溶液于另一试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 | 产生白色沉淀,酚酞溶液变红 | 猜想2成立 |
(反思与评价)I.小军评价实验操作②中加入Ca(OH)2溶液不正确,理由是_____。
若要验证猜想2成立,需将Ca(OH)2溶液换成_____溶液。
Ⅱ在实验室中氢氧化钠固体密封保存的原因是_____(用文字叙述)
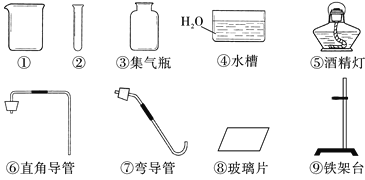
【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
A 粗盐中难溶性杂质的去除 | B 配制一定溶质质量分数的NaCl溶液 | ||||
(1)涉及到的实验操作依次是______(填序号)。 (2)蒸发过程中,需用玻璃棒不断搅拌,作用是_______。 | (1)涉及到的实验操作依次是______(填序号)。 (2)溶解过程中,需用玻璃棒不断搅拌,作用是________。 | ||||
可供选择的实验操作: | |||||
|
|
|
|
| |
A.溶解 | B. 称量固体 | C. 蒸发 | D. 过滤 | E. 量取 | |