题目内容
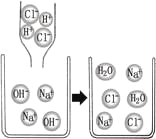
【题目】有一包固体,可能由KNO3、BaCl2、NH4Cl、Na2CO3、Na2SO4、MgCl2中的一种或几种组成,为了探究该固体组成,某化学小组将固体溶于水只得到无色溶液,白色沉淀X部分溶解,对该溶液开展以下实验,已知每个步骤的实验现象都已列出,请回答下列问题:
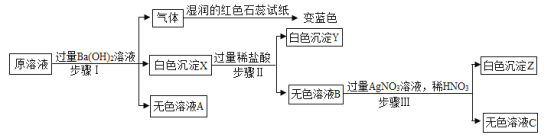
(1)原固体中一定不含的物质有_____________________。
(2)写出无色溶液C中含有的阳离子符号______________________。
【答案】BaCl2、Na2CO3H+ 、Mg2+、Ag+
【解析】
将可能由KNO3、BaCl2、NH4Cl、Na2CO3、Na2SO4、MgCl2中的一种或几种的固体与过量的氢氧化钡溶液混合产生能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,因此原白色固体中一定含有氯化铵;此外产生白色沉淀X,X可能是与碳酸钠、硫酸钠反应产生碳酸钡沉淀或硫酸钡,也可能是与氯化镁反应产生的氢氧化镁沉淀;再向沉淀中加过量的稀盐酸,产生白色沉淀Y,说明沉淀X应该是氢氧化镁和硫酸钡沉淀,因为碳酸钡沉淀溶于盐酸会产生气泡,硫酸钡沉淀不能和盐酸反应,因此说明固体中一定含有硫酸钠和氯化镁,一定没有碳酸钠及能与硫酸钠反应的氯化钡;因此:
(1)根据推断可知原固体中一定不含有的物质是BaCl2、Na2CO3;(2)无色溶液C中含有过量的硝酸银、稀硝酸及反应产生的氯化镁,因此阳离子有银离子、氢离子及镁离子。

【题目】某同学发现一瓶没有塞上瓶塞的过氧化氢溶液,对该溶液中是否有过氧化氢的剩余,与同学们一起进行如下探究实验。
(猜想与假设)
猜想⑴:该溶液中有过氧化氢的剩余。猜想⑵:该溶液中没有过氧化氢的剩余。
(方案讨论)为了验证猜想,甲、乙、丙三同学分别提出如下方案
甲:取适量试剂于试管中,伸入带火星的木条,若带火星的木条复燃,则猜想(1)成立,若带火星的木条不复燃,猜想(2)成立.
同学们认为此方案不行,原因是____________________。
乙:取少量二氧化锰于试管中,加入与甲等量的试剂,若有气泡产生,则猜想(1)成立,若无气泡产生则猜想(2)成立,理由是______(写化学反应的文字表达式)
丙:
操作 | 现象 | 结论 |
取与甲等量试剂于试管中,加热,伸入带火星的木条 | __________________ | 猜想(1)成立 |
(反思与交流)1、敞口放置的试剂容易变质,所以要______保存。
2、二氧化锰在过氧化氢的分解过程中起________作用。除此之外能改变化学反应速率的方法还可以______________