题目内容
【题目】某化学第二课堂小组利用已学过的知识,准备利用含FeSO4和CuSO4的废水(无其他难溶杂质),从中获得硫酸亚铁晶体,其流程如下图所示:
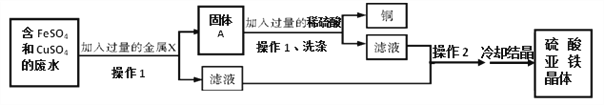
(1)整个流程中,进行了两次操作1,操作1是_____________(填操作名称)。
(2)金属X 是______(填化学符号),其加入废水后发生反应的化学方程式为:____________;固体A中含有__________(填化学符号)。写出固体A与稀硫酸反应的化学方程式为:____________________。
(3)通过冷却结晶法得到硫酸亚铁晶体前需要进行操作2,请问操作2是________。
【答案】 过滤 Fe Fe + CuSO4=Cu + FeSO4 Cu、Fe Fe + H2SO4 =FeSO4 + H2↑ 蒸发(或者蒸发浓缩)
【解析】本题考查了金属活动性顺序及其应用。
(1)操作1是将固体与液体分离,所以操作1是过滤;
(2)为除去废液中的Cu2+需加入活动性在铜前面的金属进行置换,要得到较为纯净FeSO4的溶液,只能向废液中加入过量的铁粉与硫酸铜发生置换反应,生成物中只有硫酸亚铁,加入其它金属溶液中又混有其它溶质,加入过量铁粉是为了将铜离子全部置换出来。金属X 是Fe,铁加入废水后发生的反应是铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe + CuSO4=Cu + FeSO4;加入的铁是过量的,固体A中含有Cu、Fe。铁与稀硫酸反应生成硫酸亚铁与氢气,化学方程式为:Fe + H2SO4 =FeSO4 + H2↑。
(3)通过冷却结晶法得到硫酸亚铁晶体前需要进行蒸发(或者蒸发浓缩)。操作2是蒸发(或者蒸发浓缩)。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目