题目内容
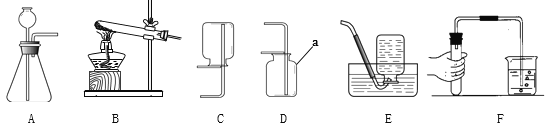
【题目】实验室制取气体所需的装置如图所示。

(1)写出仪器名称:a________b__________。
(2)实验室用高锰酸钾制取氧气,反应的化学方程式为_________,若要收集到干燥的氧气,收集装置是________ (填序号,下同),其验满方法为__________。
(3)用装置E收集氧气时,下列实验操作正确的是________(填序号2分)。
A.加热前,将集气瓶装满水,用玻璃片盖住瓶口,倒立在盛水的水槽中
B.加热后,观察到水中导管口开始有气泡时,立即收集气体
C.待集气瓶里的水排完后,在水面下用玻璃片盖住瓶口,移出水槽正放在桌面上
D.排水法收集完氧气后,先熄灭酒精灯,再将导气管从水槽中移出
(4)实验室中可以用加热氯化铵和氢氧化钙固体混合物的方法制得氨气。氨气极易溶于水,且密度小于空气。实验室中制取氨气的发生和收集装置分别为______、 _____。
【答案】酒精灯 集气瓶 2KMnO4![]() K2MnO4+MnO2+O2↑ D 把带火星的木条放在集气瓶口,若木条复燃,则说明收集满了 AC B C
K2MnO4+MnO2+O2↑ D 把带火星的木条放在集气瓶口,若木条复燃,则说明收集满了 AC B C
【解析】
(1)据图可知仪器a是酒精灯,b是集气瓶;
(2)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,用向上排空气法收集的氧气比较干燥;氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;
K2MnO4+MnO2+O2↑;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,用向上排空气法收集的氧气比较干燥;氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;
(3)A、排水法收集氧气,加热前,应将集气瓶装满水,用玻璃片盖住瓶口,倒立在盛水的水槽中,故实验操作正确;B、加热后,观察到水中导管口有气泡均匀连续冒出时,开始收集气体,故实验操作错误;C、待集气瓶里的水排完后,在水面下用玻璃片盖住瓶口,移出水槽正放在桌面上,因氧气的密度比空气大,故实验操作正确;D、排水法收集完氧气后,先将导气管从水槽中移出,再熄灭酒精灯,故实验操作错误;
(4)加热氯化铵和氢氧化钙固体混合物可制取氨气,发生装置属于固体和固体加热制气体;氨气易溶于水,不可采用排水法收集;密度比空气小,可以采用向下排空气法收集。

【题目】如图1是“空气中氧气体积分数测定”实验的改进装置。主要操作是:在实际容积为150mL的集气瓶里,先装进50mL的水,再按图1连好仪器,按下热的玻璃棒,白磷立即被点燃。(白磷40℃即燃烧,燃烧产物与红磷相同)
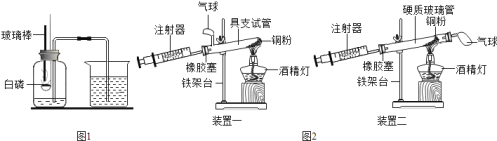
(1)白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是________,若实验成功,最终集气瓶中水的体积约为______mL。
(2)该实验可推论出氮气的物理性质为________,化学性质为________。
(3)若将白磷换成炭粉,该实验能否获得成功?为什么?_________________。
(4)集气瓶里预先装进的50mL水,在实验过程中起到哪些作用?__________(填写序号)
A.加快集气瓶内气体冷却B.液封导气管末端以防气体逸出C.吸收五氧化二磷
(5)图2是另一实验小组对测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题。(已知铜和氧气在加热的条件下反应生成氧化铜固体)
①根据下表提供的实验数据,完成如表:
硬质玻璃管中 空气的体积 | 反应前注射器中 空气体积 | 反应后注射器中 气体体积 | 实验测得空气中 氧气的体积分数 |
25mL | 15mL | 9mL |
②装置一和装置二中气球的位置不同,_________(填“装置一”或“装置二”)更合理,理由是_______。
【题目】学习了二氧化锰对过氧化氢有催化作用的知识后,某同学想:氧化铜(CuO)能否起到类似二氧化锰的作用呢?进行了如下探究。(猜想)Ⅰ.CuO参与反应产生氧气,反应前后质量和化学性质发生了改变; Ⅱ.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;Ⅲ.CuO是反应的催化剂,反应前后_______________________不变。(实验)用天平称量0.2gCuO,取5mL 5%的过氧化氢溶液于试管中,进行如下实验:
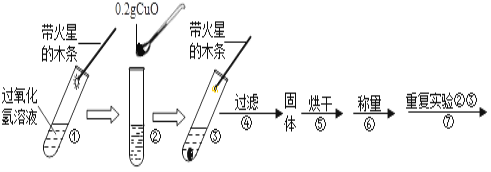
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
溶液中有气泡放出, 带火星的木条复燃 | _________________ | _________________ | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(2)步骤①的目的_______________________。
(3)过氧化氢能被氧化铜催化分解放出氧气的反应文字表达式为__________________。
(4)查阅资料知氧化铁、硫酸铜、猪肝等也可以作过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是_______(填字母代号)
A.用作催化剂的物质不可能是其他反应的反应物或生成物
B.一种物质无法对多个反应都起催化作用
C.同一化学反应可以有多种催化剂
D.催化剂能使生成氧气的质量增加
【题目】某校兴趣小组的同学从水泥厂拿来一块石灰石样品,技术员告诉他们此样品中含有的杂质难溶于水,不能与盐酸反应。为了测定该样品的纯度,同学取用8.00g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸100克分5次加入,充分反应后,经过滤、干燥等操作后称量,得到如下数据:
实 验 次 数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸的质量/g | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
剩余固体的质量/g | 6.00 | m | 2.00 | 1.20 | 1.20 |
试回答下列问题:
(l)表中m的值为_____________。
(2)该石灰石样品的纯度是__________。
(3)反应生成的气体质量是多少克?______________
(4)试计算稀盐酸的质量分数 ____________。