题目内容
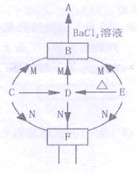
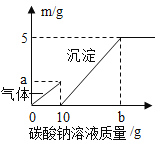
【题目】实验室提纯含有少量生石灰、泥沙的NaCl固体,进行如下提纯实验:

回答下列问题:
(1)加入Na2CO3溶液所发生反应的化学方程式为______.
(2)加入的过量X溶液作用是______.
(3)以下关于蒸发的操作正确的是______.
①蒸发皿必须放在石棉网上加热 ②蒸发完成后立即用手移去蒸发皿 ③加热蒸发时不断用玻璃棒搅拌 ④蒸发时待水分全部蒸干后停止加热.
【答案】Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 除尽B溶液中的氢氧化钠和碳酸钠 ③
【解析】
(1)氧化钙和水反应生成氢氧化钙,加入Na2CO3溶液,碳酸钠与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH。
故填:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)由题意知,加入的X是稀盐酸溶液,目的是除尽B溶液中的氢氧化钠和碳酸钠,故填:除尽B溶液中的氢氧化钠和碳酸钠;
(3)①蒸发皿可以直接加热,不须放在石棉网上加热,该说法错误;
②蒸发完成后,还有大量的余热,不能立即用手移去蒸发皿,该说法错误;
③加热蒸发时不断用玻璃棒搅拌,防止局部受热沸腾溅出,该说法正确;
④蒸发时待较多晶体析出时,停止加热,利用蒸发皿的余热把剩余的水蒸干,该说法错误;
故选③。

 阅读快车系列答案
阅读快车系列答案【题目】将一小块银白色的金属钠放置在空气中会发生下列变化:
钠(Na)![]() 钠的氧化物
钠的氧化物![]() 氢氧化钠溶液
氢氧化钠溶液![]() 白色固体
白色固体
【提出问题】:常温下钠与氧气反应,产物有哪些?
【查阅资料】:钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:
Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
【作出猜想】:常温下钠与氧气反应的产物.
猜想1:Na2O,
猜想2:Na2O2,
猜想3:
【实验探究一】:
实验操作 | 实验现象 | 实验结论 |
取少量钠的氧化物加入足量蒸馏水 | 猜想1正确 |
【继续探究】:钠在空气中放置一段时间得到白色固体的成分
【作出猜想】
猜想一:Na2CO3
猜想二:Na2CO3和NaOH
【实验探究二】:
实验操作 | 实验现象 | 实验结论 |
1.取少量白色固体加入足量 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
2.过滤、取少量滤液加入 |
【实验反思】
(1)类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式 。
(2)过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为 。
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断Na2O2 碱性氧化物(填“是”或“不是”)。