题目内容
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂.此时,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质的成分进行探究.
(1)写出该中和反应的化学方程式 。
(2)探究烧杯内溶液中溶质的成分:
【提出问题】
该烧杯内的溶液中溶质是什么?
【进行猜想】
(A)溶质可能是CaCl2与Ca(OH)2
(B)溶质可能只是CaCl2
(C)溶质可能是CaCl2与盐酸
【实验探究】
①小明从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液.振荡.观察到酚酞试液不变色.于是他排除了猜想(A),你认为他排除猜想(A)的理由是 。
②小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格:
|
实验步骤 |
预计现象 |
预计结论 |
|
取少量反应后的溶液于试管中,逐滴加入碳酸钠溶液. |
|
猜想( )正确 |
|
|
猜想( )正确 |
【反思与拓展】
你认为上述烧杯内溶液如果未经处理直接倒入铁制下水道,可能造成的危害是 .要想处理烧杯内溶液使其只得到CaCl2溶液,应向溶液中加入过量 ,充分反应后过滤,反应的方程式为 。
(1)Ca(OH)2+2HCl═CaCl2+2H2O;
【实验探究】
①酚酞溶液不变色,说明溶液不呈碱性,而猜想②的溶液呈碱性,所以可以排除.
②
|
实验步骤 |
预计现象 |
预计结论 |
|
取少量反应后的溶液于试管中,逐滴加入碳酸钠溶液. |
只有白色沉淀产生 |
猜想(B)正确 |
|
先有气泡产生,后有白色沉淀产生 |
猜想(C)正确 |
【解析】(1)氢氧化钙和盐酸发生中和反应生成氯化钙和水,故答案为:Ca(OH)2+2HCl═CaCl2+2H2O;
①根据酚酞遇碱会变红色,而待测液体加入酚酞不变色,说明溶液不呈碱性,而猜想A的溶液呈碱性,所以可以排除;②氯化钙溶液可以和碳酸钠溶液反应生成沉淀,和稀盐酸反应生成二氧化碳气体,碳酸钙盐酸存在的情况下不能以沉淀的形式析出,所以加入的碳酸钠溶液必须是足量的;(3)盐酸会与铁反应而将下水道腐蚀;除去盐酸又不能引入新的杂质,还要防止过量,只能加碳酸钙;碳酸钙和盐酸反应生成氯化钙、水和二氧化碳。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
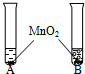
小学生10分钟应用题系列答案| 实验步骤 | 实验现象 | 实验结论 |
①将等体积的两种无色液体分别加入A、B两个试管中.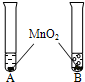 ②分别向A、B两试管中同时加入等质量(少量)的二氧化锰,观察现象. ②分别向A、B两试管中同时加入等质量(少量)的二氧化锰,观察现象. |
A试管中无明显现象 B试管中有气泡 产生 |
A试管中的无色液 体是 B试管中的无色液体是 |
(2)写出B试管中发生反应的文字表达式:
某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取CO2气体.请你参与下列的探究并回答问题.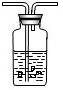
[提出问题]上述酸和碳酸盐的反应是否适合在实验室制取CO2气体.
[方案设计]大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2气体,原因是浓盐酸挥发出的HCl气体混于CO2中,使制得的气体不纯.小明设计了右图装置来除去CO2中HCl,洗气瓶中盛装的液体可以是______(填序号).
①浓硫酸 ②碳酸氢钠溶液 ③氢氧化钠溶液 ④澄清石灰水
[实验与结论]
该小组设计了三个实验进行对比
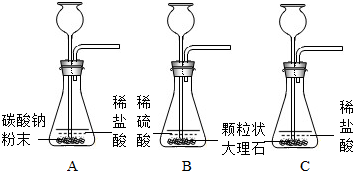
(1)请你填写实验C的实验现象和实验结论
| 实验 | 实验现象 | 实验结论 |
| A | 剧烈反应,迅速放出大量气体 | 反应速度过快,气体不便收集,不宜用于实验室制取CO2 |
| B | 产生气泡,速度迅速减慢,几秒钟后反应几乎停止 | 无法持续产生气体,不能用于实验室制取CO2 |
| C | ______ | ______ |
[拓展迁移]
将上述实验C反应后的混合物过滤.对滤液中的溶质,小聪同学提出了以下三种猜想:
①溶质是HCl;②溶质是CaCl2;③溶质是HCl和CaCl2
该小组成员一起讨论后认为,上述三种猜想中有一种是不合理的,你认为不合理的猜想是______(填序号).对小聪的另外两种合理猜想,请你设计实验,并根据不同现象说明溶液中的溶质属于哪一种猜想______.

 被称为“生命之源”的水(H2O)和被称为“绿色氧化剂”的过氧化氢(H2O2),都是由氢、氧两种元素组成的化合物,通常情况下均为无色液体.某实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体.请回答有关问题:
被称为“生命之源”的水(H2O)和被称为“绿色氧化剂”的过氧化氢(H2O2),都是由氢、氧两种元素组成的化合物,通常情况下均为无色液体.某实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体.请回答有关问题: