题目内容
(2010?攀枝花)某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取CO2气体.请你参与下列的探究并回答问题.
[提出问题]上述酸和碳酸盐的反应是否适合在实验室制取CO2气体.
[方案设计]大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2气体,原因是浓盐酸挥发出的HCl气体混于CO2中,使制得的气体不纯.小明设计了右图装置来除去CO2中HCl,洗气瓶中盛装的液体可以是
①浓硫酸 ②碳酸氢钠溶液 ③氢氧化钠溶液 ④澄清石灰水
[实验与结论]
该小组设计了三个实验进行对比
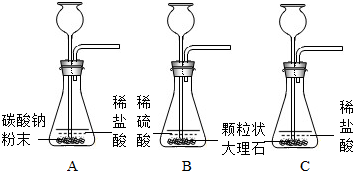
(1)请你填写实验C的实验现象和实验结论
(2)根据实验探究,实验室制取CO2的化学反应原理为(用化学方程式表示)
[拓展迁移]
将上述实验C反应后的混合物过滤.对滤液中的溶质,小聪同学提出了以下三种猜想:
①溶质是HCl;②溶质是CaCl2;③溶质是HCl和CaCl2
该小组成员一起讨论后认为,上述三种猜想中有一种是不合理的,你认为不合理的猜想是

[提出问题]上述酸和碳酸盐的反应是否适合在实验室制取CO2气体.
[方案设计]大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2气体,原因是浓盐酸挥发出的HCl气体混于CO2中,使制得的气体不纯.小明设计了右图装置来除去CO2中HCl,洗气瓶中盛装的液体可以是
②
②
(填序号).①浓硫酸 ②碳酸氢钠溶液 ③氢氧化钠溶液 ④澄清石灰水
[实验与结论]
该小组设计了三个实验进行对比

(1)请你填写实验C的实验现象和实验结论
| 实验 | 实验现象 | 实验结论 |
| A | 剧烈反应,迅速放出大量气体 | 反应速度过快,气体不便收集,不宜用于实验室制取CO2 |
| B | 产生气泡,速度迅速减慢,几秒钟后反应几乎停止 | 无法持续产生气体,不能用于实验室制取CO2 |
| C | 产生气泡,反应速率均匀、适中,持续放出气体 产生气泡,反应速率均匀、适中,持续放出气体 |
产生气体的速率均匀、适中,便于收集气体,适合实验室制取CO2 产生气体的速率均匀、适中,便于收集气体,适合实验室制取CO2 |
CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
.[拓展迁移]
将上述实验C反应后的混合物过滤.对滤液中的溶质,小聪同学提出了以下三种猜想:
①溶质是HCl;②溶质是CaCl2;③溶质是HCl和CaCl2
该小组成员一起讨论后认为,上述三种猜想中有一种是不合理的,你认为不合理的猜想是
①
①
(填序号).对小聪的另外两种合理猜想,请你设计实验,并根据不同现象说明溶液中的溶质属于哪一种猜想取滤液少许于试管中,向其中滴加几滴紫色石蕊试液,若不出现红色,则说明是猜想
②;若出现红色,则说明是猜想③
②;若出现红色,则说明是猜想③
取滤液少许于试管中,向其中滴加几滴紫色石蕊试液,若不出现红色,则说明是猜想
②;若出现红色,则说明是猜想③
.②;若出现红色,则说明是猜想③
分析:根据气体除杂的原则,既能除掉杂气又不能引人新杂质选择洗气液;实验室制取二氧化碳气体的反应原理进行分析解答本题.
解答:解:【方案设计】除去CO2中HCl,洗气瓶中盛装的液体既要吸收盐酸又不能与二氧化碳反应,题中浓硫酸不能吸收盐酸,氢氧化钠和石灰水都与二氧化碳反应,只有碳酸氢钠适合,故选②;
【实验与结论】
(1)实验A:碳酸钠粉末易溶于水,与盐酸接触面积大,剧烈反应,迅速放出大量气体,不利于气体收集;
实验B:粒状大理石与稀硫酸反应,生成硫酸钙微溶于水,附着在大理石表面,产生气泡,速度迅速减慢,几秒钟后反应几乎停止,无法持续产生气体;
实验C:粒状大理石与稀盐酸反应产生气泡,反应速率均匀、适中,持续放出气体,便于气体的收集,适合实验室制取CO2;
(2)制取二氧化碳的反应原理为:CaCO3+2HCl═CaCl2+H2O+CO2↑
【拓展与迁移】实验室制取CO2的化学反应原理可知,实验C反应后的混合物过滤,对滤液中的溶质可能为溶质是CaCl2或HCl和CaCl2,不可能只有HCl;要验证猜想可利用两种猜想中溶质性质的不同来设计实验,如氯化钙溶液为中性,溶质为含有HCl和CaCl2的溶液为酸性,可滴加紫色石蕊试液来验证.
故答案为:
【方案设计】②;
【实验与结论】
(1)
(2)CaCO3+2HCl=CaCl2+CO2↑+H2O;
①(1分)取滤液少许于试管中,向其中滴加几滴紫色石蕊试液,若不出现红色,则说明是猜想②;若出现红色,则说明是猜想③(合理都给分).
【实验与结论】
(1)实验A:碳酸钠粉末易溶于水,与盐酸接触面积大,剧烈反应,迅速放出大量气体,不利于气体收集;
实验B:粒状大理石与稀硫酸反应,生成硫酸钙微溶于水,附着在大理石表面,产生气泡,速度迅速减慢,几秒钟后反应几乎停止,无法持续产生气体;
实验C:粒状大理石与稀盐酸反应产生气泡,反应速率均匀、适中,持续放出气体,便于气体的收集,适合实验室制取CO2;
(2)制取二氧化碳的反应原理为:CaCO3+2HCl═CaCl2+H2O+CO2↑
【拓展与迁移】实验室制取CO2的化学反应原理可知,实验C反应后的混合物过滤,对滤液中的溶质可能为溶质是CaCl2或HCl和CaCl2,不可能只有HCl;要验证猜想可利用两种猜想中溶质性质的不同来设计实验,如氯化钙溶液为中性,溶质为含有HCl和CaCl2的溶液为酸性,可滴加紫色石蕊试液来验证.
故答案为:
【方案设计】②;
【实验与结论】
(1)
| 产生气泡,反应速率均匀、适中,持续放出气体 | 产生气体的速率均匀、适中,便于收集气体,适合实验室制取CO2 |
①(1分)取滤液少许于试管中,向其中滴加几滴紫色石蕊试液,若不出现红色,则说明是猜想②;若出现红色,则说明是猜想③(合理都给分).
点评:本题综合考查了二氧化碳的实验室制法,并进一步探究了反应原理,提高了同学们对实验室制取二氧化碳的认识.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目