题目内容
将3.6g碳酸钙高温煅烧一段时间后冷却,测得固体剩余物中钙元素的质量分数为57.6%,求固体混合物中氧化钙的质量。
80%
试题分析:质量守恒定律告诉我们,化学反应前后,元素的种类、质量均不变,碳酸钙高温煅烧,发生反应:CaCO3
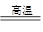 CaO+CO2↑,即CaCO3中钙元素质量等于CaO中钙元素质量,这样便可算出反应后固体剩余物的质量,再根据质量守恒定律,前后固体的质量差就是二氧化碳的质量,而在化学方程式中可以根据CaO与二氧化碳的质量关系,从而算出氧化钙的质量
CaO+CO2↑,即CaCO3中钙元素质量等于CaO中钙元素质量,这样便可算出反应后固体剩余物的质量,再根据质量守恒定律,前后固体的质量差就是二氧化碳的质量,而在化学方程式中可以根据CaO与二氧化碳的质量关系,从而算出氧化钙的质量解解:3.6g碳酸钙中钙质量=3.6g×40/100×100%=1.44g
反应后剩余物质量=1.44÷57.6%=2.5g
生成CO2的质量=3.6g-2.5g=1.1g
设固体混合物中氧化钙的质量为x
CaCO3
 CaO + CO2↑
CaO + CO2↑56 44
x 1.1g
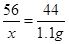
x=1.4g

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



 2CuSO4 + 2H2O)现有溶质的质量分数为10%的稀硫酸(其中含溶质98 g)与铜恰好完全反应,假设硫酸不和其他杂质反应,求反应后硫酸铜溶液中溶质的质量分数。(最后结果精确到0.1%)
2CuSO4 + 2H2O)现有溶质的质量分数为10%的稀硫酸(其中含溶质98 g)与铜恰好完全反应,假设硫酸不和其他杂质反应,求反应后硫酸铜溶液中溶质的质量分数。(最后结果精确到0.1%)