题目内容
【题目】某研究性学习小组为验证“氨气还原氧化铜”的实验,认真查阅资料并做出以下准备。
资科准备:
Ⅰ.氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,溶液呈碱性。
Ⅱ.氨气还原氧化铜的化学反应原理2NH3+3CuO![]() 3Cu+N2+3H2O
3Cu+N2+3H2O
实验准备:
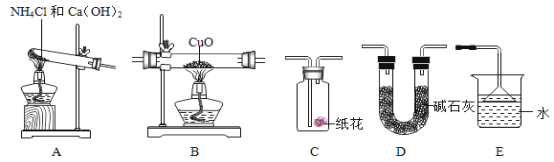
请回答:
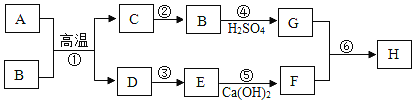
①为达成“氨气还原氧化铜”的实验目的,装置A、B、D、E的正确连接顺序_____ (填序号);
②装置A中发生反应的化学方程式_____;
③装置B观察到的现象_____,装置E的作用_____;
④装置A产生的气体通入装置C中,石蕊试液浸泡的纸花变蓝色,原因是_____。
【答案】A、D、B、D、E Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑ 黑色氧化铜逐渐变成红色 吸收氨气,防止污染环境 氨气溶于水,形成氨水,氨水能使紫色石蕊显蓝色
CaCl2+2H2O+2NH3↑ 黑色氧化铜逐渐变成红色 吸收氨气,防止污染环境 氨气溶于水,形成氨水,氨水能使紫色石蕊显蓝色
【解析】
①氢氧化钙和氯化铵在加热的条件下生成氯化钙、水和氨气,氨气溶于水形成氨水,碱石灰具有吸水性,氨气和氧化铜在加热的条件下生成铜、水和氮气,需要尾气处理;为达成“氨气还原氧化铜”的实验目的装置A、B、D、E的正确连接顺序:A、D、B、D、E;故填::A、D、B、D、E
②装置A中发生的反应是氢氧化钙和氯化铵反应生成氯化钙、水和氨气,化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑;故填:Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑;故填:Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
③装置B观察到的现象为:黑色氧化铜逐渐变成红色,装置E的作用是:吸收氨气,防止污染环境;故填:黑色氧化铜逐渐变成红色;吸收氨气,防止污染环境
④将装置A产生的气体通入装置C中,石蕊试液浸泡的纸花变蓝色,原因是:氨气溶于水,形成氨水,氨水能使紫色石蕊显蓝色;故填:氨气溶于水,形成氨水,氨水能使紫色石蕊显蓝色