题目内容
【题目】金属与人类的生产、生活密切相关,牢固掌握金属的知识十分必要。
(1)下列用途是利用金属的导电性的是(填字母)______。
A 铜做导线
B 铝合金做门窗
C 铁锅作炊具
D 金作戒指
(2)将一小块金属钠放入滴有无色酚酞溶液的水中,钠剧烈反应,可观察到其熔成小球,在水面上游动,溶液变成红色,已知该反应产生了一种可燃性气体。请写出该反应的化学方程式。______
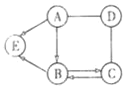
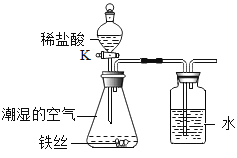
(3)将铁丝放在潮湿的空气中(如图所示),一周后,除观察到铁丝生锈,还能观察到的现象是______;打开K后,观察到铁锈消失,写出该反应的化学方程式______;随着盐酸的滴加,一段时间后,可以观察到导管口有气泡冒出,请解释产生该现象的原因________________。
(4)向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定量的锌粉充分反应,过滤得到滤液和滤渣。
①某同学对滤渣成分作出猜想:可能为Ag; 可能为Ag、Cu、Zn,滤渣的成分还可能是什么?_________________
②向滤渣中加入盐酸,若有气泡放出,则滤液中一定含有的金属离子有哪些(写符号)?__________________
(5)现有含氧化铁60%的铁矿石480吨,理论上可得到含铁96%的生铁多少吨?______________________
【答案】A 2Na+2H2O=2NaOH+H2↑ 集气瓶中导管内液面上升 Fe2O3+6HCl═2FeCl3+3H2O 铁和盐酸反应生成了氯化亚铁和氢气 Ag、Cu 镁离子、锌离子 210t
【解析】
(1)下列用途是利用金属的导电性的是铜做导线。故填:A。
(2)由质量守恒定律可知,生成的气体可能是氧气、氢气等,该反应产生了一种可燃性气体,说明生成的气体是氢气,即钠和水反应生成氢氧化钠和氢气,该反应的化学方程式为:2Na+2H2O=2NaOH+H2↑。故填:2Na+2H2O=2NaOH+H2↑。
(3)将铁丝放在潮湿的空气中(如图所示),一周后,除观察到铁丝生锈,由于氧气被消耗,气压减小,还能观察到的现象是集气瓶中导管内液面上升;打开K后,观察到铁锈消失,是因为氧化铁和盐酸反应生成了氯化铁和水,该反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;
随着盐酸的滴加,一段时间后,可以观察到导管口有气泡冒出,这是因为铁和盐酸反应生成了氯化亚铁和氢气。故答案为:集气瓶中导管内液面上升;Fe2O3+6HCl═2FeCl3+3H2O;铁和盐酸反应生成了氯化亚铁和氢气。
(4)①向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一定量的锌粉,锌先与硝酸银反应,再与硝酸铜反应,不与硝酸镁反应。某同学对滤渣成分作出猜想:可能为Ag; 可能为Ag、Cu、Zn,滤渣的成分还可能是Ag、Cu;向滤渣中加入盐酸,若有气泡放出,说明锌过量,硝酸银、硝酸铜已经完全反应,则滤液中一定含有的金属离子有:未参加反应的硝酸镁中的镁离子、反应生成硝酸锌中的锌离子。
故答案为:Ag、Cu;镁离子、锌离子。
(5)解:设理论上反应生成铁的质量为x

故答案为:210t。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案